Электрохимические и коррозионные процессы
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимия является разделом физической химии, в котором изучают закономерности процессов, протекающих при взаимном превращении электрической и химической форм энергии.
Химические процессы, в ходе которых происходит переход электронов от атомов, входящих в состав одного из реагентов – восстановителя, к атомам, входящим в состав другого реагента – окислителя, называются окислительно-восстановительными. При протекании этих реакций происходит одновременное окисление восстановителя и восстановление окислителя за счет перераспределения электронов:

где Red1 – восстановленная, а Ox1 – окисленная форма вещества 1, а Red2, Ox2 соответственно вещества 2 (Red – от reduction – восстановление; Ox – от oxidation – окисление).
Процессы окисления и восстановления протекают в любой точке реакционного пространства при непосредственном контакте частиц восстановителя и окислителя. В гомогенной системе это происходит во всем объеме, занимаемом реагентами, а в гетерогенной - на границе раздела фаз. Они могут также быть разделены в пространстве, когда процессы окисления протекают в одной части системы, а процессы восстановления в другой. В этом случае в реакционной системе может осуществляться перенос зарядов между ее частями, т. е. будет протекать электрический ток.
Основные понятия и определения
Если окислительный и восстановительный процессы разделены в пространстве, то переход электронов от восстановителя к окислителю в самопроизвольном процессе (DrG<0) может быть использован для получения электрической энергии. При использовании ее внешнего источника можно осуществлять вынужденные химические реакции (DrG>0). Таким образом происходит непосредственное взаимное превращение химической и электрической форм энергии. Такие окислительно-восстановительные процессы называются электрохимическими и происходят в электрохимической системе (рис.8.1).
Рис. 8‑1 Электрохимическая система: 1 – электроды (А – анод, К – катод); 2 – электролиты; 3 – внешняяцепь; 4 – внутренняя цепь; 5 – проводник электрического тока или внешний источник электрической энергии
Электрохимическая система включает в себя:
электроды – проводники с электронным типом проводимости (чаще всего металл), находящиеся в контакте с электролитом;
электролит – проводник с ионным типом проводимости (раствор веществ, диссоциирующих на ионы);
внешнюю цепь – проводники, обеспечивающие возможность перехода электронов между электродами (протекания электрического тока);
внутреннюю цепь – проводник с ионным типом проводимости, обеспечивающий возможность перехода ионов.
Электрод, на поверхности которого происходит реакция окисления, называется анодом, а на поверхности которого происходит реакция восстановления – катодом:
М1x® M1x+n + nē – анодный процесс (Red1 ® Ox1 + nē),
М2x + nē ® M2x-n – катодный процесс (Ox2 + nē ® Red2).
Электрохимический процесс сопровождается переносом зарядов. Во внешней цепи электроны движутся от анода к катоду, а во внутренней – катионы к катоду, а анионы к аноду.
Электрохимическую систему принято изображать в виде условной схемы: слева записывается анод с электролитом, справа катод с электролитом; граница раздела «электрод – электролит» обозначается вертикальной линией; граница раздела между анодным и катодным электролитами, обеспечивающая возможность перехода ионов (ионный проводник), – двумя вертикальными параллельными линиями.
Пример. Анод – цинк, находящийся в контакте с раствором сульфата цинка; катод – медь, находящаяся в контакте с сульфатом меди:
Zn|ZnSO4||CuSO4|Cu Zn|Zn+2||Cu+2|Cu
Если электрохимическая система находится в состоянии равновесия (DG = 0), то ток в цепи равен нулю. Во внешней цепи не происходит перенос электронов и, соответственно, отсутствует направленное движение ионов во внутренней цепи.
Если в электрохимической системе протекает ток, то она выходит из состояния равновесия и электрохимический процесс становится неравновесным. Он является самопроизвольным, если DG < 0. Если DG > 0, то протекание вынужденного процесса обеспечивается включением во внешнюю цепь источника электрической энергии.
При самопроизвольном процессе в результате протекания реакций на поверхности электродов энергия химических связей превращается в электрическую. В этом случае электрохимическая система называется гальваническим элементом, который может служить химическим источником тока (ХИТ).
При осуществлении вынужденного электрохимического процесса за счет внешнего источника электрической энергии на поверхности электродов протекают реакции превращения веществ. При этом электрическая энергия переходит в энергию новых химических связей. Химические процессы, осуществляемые за счет электрической энергии, называются электролизом, а электрохимическая система – электролизером. Эти процессы используют, например, для получения металлов и газов, а также при зарядке обратимых ХИТ (аккумуляторов).
Электрохимический процесс является гетерогенным, т. к. включает в себя окислительно-восстановительную реакцию, протекающую на поверхности электродов. Кроме того, он сопровождается направленным переносом заряженных частиц, электронов и ионов. В этом случае, помимо непосредственных процессов приема и отдачи электронов частицами в неравновесных условиях, большую роль играют подвод ионов к поверхности электродов и отвод продуктов реакции от нее.
Направленное движение заряженных частиц, в частности электронов, во внешней цепи происходит, если между электродами в электрохимической системе существует разность потенциалов E. Работа переноса электрических зарядов между электродами (Wэ) может быть выражена через число молей электронов (n) и заряда одного моля электронов (F » 96500 Кл/моль – число Фарадея): Wэ = n×F×E.
Изменение энергии Гиббса в электрохимическом процессе равно ее изменению в результате протекания химической реакции (DrG) плюс работа переноса электрических зарядов между электродами (Wэ), имеющими разность потенциалов (E):
DG=DrG + Wэ ® DG=DrG + n×F×E,
где F – число Фарадея.
В состоянии равновесия DG=0. Следовательно, разность потенциалов электродов равна: 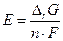 . Термодинамическое условие самопроизвольного протекания процесса – DrG<0. Следовательно, при работе гальванического элемента E>0. Если потенциал катода составляет величину jк, а потенциал анода jа, то E = jк – jа > 0 и jк > jа. В случае вынужденного процесса DrG>0. Следовательно, при электролизе разность потенциалов электродов E<0 и соответственно jк < jа.
. Термодинамическое условие самопроизвольного протекания процесса – DrG<0. Следовательно, при работе гальванического элемента E>0. Если потенциал катода составляет величину jк, а потенциал анода jа, то E = jк – jа > 0 и jк > jа. В случае вынужденного процесса DrG>0. Следовательно, при электролизе разность потенциалов электродов E<0 и соответственно jк < jа.
При записи электрохимических процессов принято обозначать электроды с относительно большим потенциалом знаком «+», а с относительно меньшим потенциалом знаком «-». Таким образом, в гальваническом элементе потенциал анода будет отрицательным, а катода «положительным. В электролизере наоборот анод будет «+», катод «-».
Количественные соотношения между величиной тока I и количеством веществ, израсходованных или образовавшихся в результате протекания химических реакций на поверхности электродов, можно получить, проведя следующие рассуждения. Пусть на поверхности анода протекает реакция Маx ® Mаx+n + nē, а на поверхности катода Мкx + nē ® Mкx-n. Тогда при осуществлении единичного акта электрохимического процесса на аноде исчезнет одна частица Маx и одновременно на катоде одна частица Мкx, с возникновением частиц Mаx+n и Mкx-n соответственно. При этом во внешней цепи осуществится перенос с анода на катод n электронов. Очевидно, что при превращении на электродах одного моля веществ (NA частиц) во внешней цепи произойдет перенос n×NA электронов. Поскольку заряд электрона ē=1,6×10-19 Кл, то за время превращения (t) на электродах одного моля веществ во внешней цепи произойдет перенос n×NA×ē Кл электричества. Измеряемой характеристикой является величина тока во внешней цепи. При токе равном I =1 А за t = 1 с осуществляется перенос 1 Кл электричества, следовательно, если в течение времени t с во внешней цепи протекал ток I А, то на электродах произойдет превращение n молей веществ:
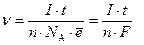 [моль].
[моль].
Заряд одного моля электронов NA×ē является постоянной величиной, которую принято называть числом Фарадея (F):
F = NA×ē=6,02×1023×1,6×10-19 » 96500 Кл/моль.
Физический смысл числа Фарадея – количество электричества, которое переносится в электрохимической системе при окислении на аноде и соответственно восстановлении на катоде одного моля веществ, если в единичном акте анодных или катодных реакций участвует один электрон.
Примечание. В общем случае число электронов, участвующих в единичном акте реакции (n), для катодного и анодного процесса может различаться. Если в результате протекания тока в электрохимической системе произведен перенос q = 1 F [Кл] количества электричества, то на электродах произойдет превращение n = 1/n молей веществ, т. е. 1 моль эквивалентов.
Массы веществ, прореагировавших на электродах, можно рассчитать, умножив число молей на молярную массу М [г/моль] соответствующего вещества, а объем газов при нормальных условиях – умножив число молей на молярный объем V = 22,4 [л/моль]:
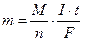 [г],
[г], 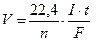 [л].
[л].
В реальных процессах часть электрической энергии расходуется не на основные процессы, а, например, на нагрев проводников или на протекание побочных химических реакций. Эффективность электролиза учитывает коэффициент выхода по току h, равный отношению действительной массы вещества (m) к теоретически рассчитанной (mр) 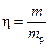 . Очевидно, что h<1, то есть количество веществ будет получаться меньше, чем расчетное
. Очевидно, что h<1, то есть количество веществ будет получаться меньше, чем расчетное 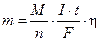 [г]. В самопроизвольном процессе при работе гальванического элемента для получения заданного количества электричества (q) веществ будет расходоваться больше, чем расчетное. Эффективность работы гальванического элемента характеризует коэффициент использования вещества (l). Если в реальном процессе при превращении m г вещества получено
[г]. В самопроизвольном процессе при работе гальванического элемента для получения заданного количества электричества (q) веществ будет расходоваться больше, чем расчетное. Эффективность работы гальванического элемента характеризует коэффициент использования вещества (l). Если в реальном процессе при превращении m г вещества получено 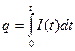 количества электричества, то l = q/qр, где qр – расчетное количество электричества.
количества электричества, то l = q/qр, где qр – расчетное количество электричества.
Впервые соотношения между количеством электричества, прошедшего через электрохимическую систему, и количеством веществ, участвовавших в реакциях, экспериментально были установлены в начале XIX в. Майклом Фарадеем (Faraday), поэтому они часто называются законами Фарадея.
Дата добавления: 2017-02-20; просмотров: 1107;
