Кипение и кристаллизация растворов
Кипение жидкости наступает, когда давление насыщенных паров становится равным внешнему давлению. Растворенное вещество понижает давление насыщенного пара растворителя над раствором. Это приводит к повышению температуры кипения раствора по сравнению с чистым растворителем. Величина изменения температуры кипения зависит только от концентрации частиц растворенного вещества, и не зависит от их природы. На диаграмме состояния (рис.6.4) для раствора концентрации С понижению давления насыщенных паров на величину Dр соответствует повышение температуры кипения DТкип при р0 = 1,013×105 Па.
Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
DТкип= Kэб×См,
где DТкип – повышение температуры кипения раствора по сравнению с чистым растворителем; См – моляльная концентрация растворенного вещества (число молей растворенного вещества, содержащихся в 1 кг растворителя); Kэб – эбуллиоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества. Эбуллиоскопическую постоянную растворителя можно вычислить, зная его температуру кипения (Tкип,К) и энтальпию парообразования (DvH, Дж/кг): 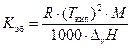 ,
,
R – универсальная газовая постоянная; М – молярная масса растворителя.
Кристаллизация раствора происходит при температуре более низкой, чем температура кристаллизации чистого растворителя. Это вызвано взаимодействием частиц растворенного вещества с молекулами растворителя, которое препятствует образованию кристаллической структуры. На диаграмме состояния (см. рис.7.4) понижение температуры кристаллизации DТкр соответствует расстоянию между кривыми 2¢ и 2, измеренному по изобаре р0 = 1,013×105 Па.
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
DТкр= Kкр×См,
где DТкр– понижение температуры кристаллизации раствора по сравнению с чистым растворителем; Kкр – криоскопическая постоянная растворителя. Она характеризует растворитель и не зависит от природы растворенного вещества.
Криоскопическую постоянную растворителя можно вычислить, зная температуру кристаллизации растворителя (Tкр,К) и энтальпию плавления(DmH, Дж/кг): 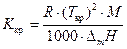 .
.
Эбуллиоскопические и криоскопические постоянные некоторых растворителей:
| Растворитель | Ткип °С | Kэб К×кг/моль | Ткр °С | Kкр К×кг/моль |
| Вода H2O | 0,51 | 1,86 | ||
| Ацетон (CH3)2CO | 56,3 | 1,71 | -95 | 2,40 |
| Бензол C6H6 | 80,1 | 2,53 | 5,53 | 5,12 |
| Четыреххлористый углерод CCl4 | 76,7 | 4,95 | -23 |
Электролиты
Свойства растворов, зависящие от числа частиц растворенного вещества, а не от их химической природы, в частности повышение температуры кипения и понижение температуры кристаллизации, получили название коллигативных свойств.
В растворе электролита за счет диссоциации увеличивается число частиц по сравнению с раствором неэлектролита той же концентрации. Это должно отразиться на коллигативных свойствах растворов электролитов. Следовательно, повышение температуры кипения и понижение температуры кристаллизации растворов будет зависеть не только от концентрации, но и от степени диссоциации растворенного вещества. Кроме того, при диссоциации молекулы в зависимости от ее химического состава образуется различное количество ионов. Увеличение числа частиц в растворе электролита характеризует изотонический коэффициент (i).
Если при растворении вещества KatxAny устанавливается динамическое равновесие: KatxAny ↔ x Kat+ + y An-, то изотонический коэффициент равен отношению суммарного числа частиц (ионов и недиссоциированных молекул) в растворе к числу растворенных молекул:
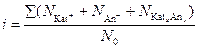 ,
,
где N0– число молекул растворенного вещества; S(Ni) – суммарное число катионов, анионов и недиссоциированных молекул растворенного вещества.
Если степень диссоциации вещества равна a, то с учетом уравнения диссоциации изотонический коэффициент
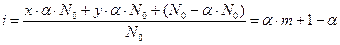 ,
,
i =a×(m –1)+1,
где x – число катионов, y – число анионов, m = x + y – суммарное число частиц, образующихся в результате единичного акта диссоциации.
В случае сильного электролита (a®1) все растворенные молекулы распадаются на ионы и изотонический коэффициент равен i = m.
Пример.
NaCl ® Na+ + Cl- i = m =1+1=2,
CaCl2 ® Ca2+ + 2Cl- i = m =1+2=3
K2SO4 ® 2 K+ + SO42- i = m =2+1=3.
В соответствии с изотоническим коэффициентом в i раз возрастают эффекты повышения температуры кипения и понижения температуры кристаллизации, а также величины относительного понижения давления насыщенных паров растворителя и осмотического давления:
DТкип= i×Kэб×См ,DТкр = i×Kкр×См , 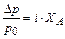
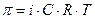 .
.
Контрольные вопросы.
1. Термодинамическое условие химического равновесия. Константа равновесия.
2. Сдвиг равновесия. Изобара и изотерма реакции.
3. Кинетическое условие химического равновесия. Константа равновесия.
4. Расчет равновесного состава газовой реакции.
5. Растворы. Электролитическая диссоциация. Константа диссоциации.
6. Ионное произведение воды. Водородный показатель.
7. Расчет pH растворов кислот и оснований.
8. Произведение растворимости. Расчет растворимости малорастворимых веществ.
9. Гидролиз солей. pH растворов солей.
10. Межфазное равновесие. Диаграмма состояния однокомпонентной системы.
11. Закон Рауля. Диаграмма состояния двухкомпонентной системы.
12. Кристаллизация и кипение растворов. Изотонический коэффициент.
Дата добавления: 2017-02-20; просмотров: 2644;
