Поляризация электродов
Поскольку потенциал электродов при протекании тока в системе определяется гетерогенной химической реакцией, то величина поляризации зависит от скорости ее отдельных стадий.
Электродный процесс, являясь сложной химической реакцией, включает в себя следующие основные стадии:
- подвод реагирующих частиц из объема электролита к поверхности электрода;
- собственно электрохимическую реакцию на электродах;
- отвод продуктов реакции от электрода.
Перенос электронов во внешней цепи осуществляется со скоростью существенно большей, чем скорости отдельных стадий электрохимической реакции. Это приводит к изменению потенциала электродов, т. е. к появлению поляризации. Необходимо отметить, что важную роль в поляризации электродов могут играть фазовые превращения – образование или разрушение кристаллической решетки твердых веществ и образование в электролите пузырьков газообразных продуктов реакции.
Отдельные стадии электродного процесса протекают с различными скоростями. При этом самая медленная (лимитирующая) стадия чаще всего и определяет общую скорость процесса.
Если известно, какая стадия является лимитирующей, то вместо термина «поляризация» используют термин «перенапряжение». Различают диффузионное перенапряжение, если самой медленной стадией является подвод или отвод реагентов, и электрохимическое, если лимитирующей является собственно электрохимическая реакция.
Диффузионное перенапряжение связано с изменением вблизи поверхности электродов концентрации реагирующих частиц вследствие протекания реакций окисления или восстановления.
Пусть электрохимическую систему образуют электроды первого рода. Потенциал каждого электрода определяется уравнением Нернста:
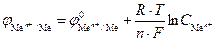 .
.
При наличии тока в системе на катоде протекает реакция восстановления катионов: Men+ + nē ® Me. Это приводит к уменьшению концентрации ионов Men+ вблизи поверхности электрода. Диффузия ионов из объема раствора будет стремиться компенсировать эту убыль. В стационарном состоянии скорость убыли ионов, пропорциональная плотности тока, будет равна скорости прихода ионов за счет диффузии, которая пропорциональна разности концентраций ионов в приповерхностном объеме и растворе (градиенту концентрации). В стационарном состоянии концентрация ионов в приповерхностном объеме будет меньше, чем при равновесии. Причем ее величина зависит от плотности тока (i). В соответствии с уравнением Нернста уменьшается величина электродного потенциала катода:
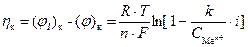 ,
,
где k – константа, зависящая от природы электродного процесса (включает в себя коэффициент диффузии, толщину диффузионного слоя и др.).
На аноде протекает реакция окисления: Me ® Me n+ + nē. Это приводит к тому, что в стационарном состоянии концентрация ионов в приповерхностном объеме будет больше, чем при равновесии. В соответствии с уравнением Нернста увеличивается величина электродного потенциала анода:
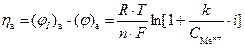 .
.
При электрохимическом перенапряжении самой медленной, лимитирующей стадией является собственно электрохимическая реакция. Оно связано с изменением величины электродного потенциала вследствие более медленного протекания электродных реакций по сравнению с перемещением электронов во внешней цепи.
При протекании тока в системе на катоде происходит реакция восстановления катионов: Men+ + nē ® Me. Ионы Men+ не успевают восстанавливаться (разряжаться), и на катоде накапливается избыток электронов, перешедших с анода. Это приводит к уменьшению потенциала катода по сравнению с его равновесным значением. Величина перенапряжения (hк) будет увеличиваться с ростом плотности тока.
Соответственно на аноде при протекании тока происходит реакция окисления: Me ® Me n+ + nē. Если скорость ухода электронов выше скорости их генерации в результате реакции, то потенциал анода будет увеличиваться. Величина перенапряжения (hа) увеличивается с ростом плотности тока.
Величина электрохимического перенапряжения (h) в зависимости от плотности тока (i) может быть описана уравнением
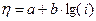 ,
,
где a и b – константы, зависящие от природы электрода.
Аналогичную зависимость Юлиус Тафель (Tafel) получил экспериментально при изучении перенапряжения при выделении водорода, поэтому она получила название уравнение Тафеля.
Примечание. Если в электрохимическом процессе происходит образование новой фазы твердых, жидких или газообразных продуктов, то это может вносить свой вклад в поляризацию.
Дата добавления: 2017-02-20; просмотров: 1249;
