III. Энергетика химических процессов
Пример. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ вычислите ΔG298 реакции, протекающей по уравнению
СО(г) + Н2О(ж) = СО2 (г) + Н2(г)
Возможна ли эта реакция при стандартных условиях?
Решение: Возможность самопроизвольного протекания реакции определяется значением изменения энергии Гиббса: ΔG298 = Но –Т •ΔSо ; Н и S – функции состояния, поэтому
ΔНо х.р = ∑ΔНопрод – ∑ΔНоисх ; ΔSо х.р = ∑ΔSопрод – ∑ΔSоисх
ΔНо х.р = (- 393,51 + 0) – ( - 110,52 – 285,84) = + 2,85 кДж;
ΔSох.р= (213,65+130,59) – (197,91+69,94) = +76,39 Дж/(моль.К) = +76,39.10-3 кДж/(моль.К);
ΔG298 = + 2,85 – 298 • 0,07639 = - 19,91 кДж.
Вывод: слева направо при 25оС реакция протекает самопроизвольно, поскольку ΔGо298< 0.
IV. Химическая кинетика и химическое равновесие.
Пример 1. В системе: СО(г) + Сl2(г) = COCl2(г) концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию хлора – от 0,2 до 0,6 моль/л. Определить, во сколько раз возрастет скорость реакции?
Решение. На основании закона действия масс скорость гомогенной реакции (V) выражается через концентрации реагирующих веществ следующим образом:
V = k ∙ [СО] ∙[Cl2],
где [СО] – молярная концентрация оксида углерода (II), моль/л;
[Cl2] – молярная концентрация хлора, моль/л;
k – коэффициент пропорциональности (константа скорости).
Начальная скорость: Vo = k ∙ 0,3 ∙ 0,2 = k ∙0,06.
С увеличением концентраций реагирующих веществ она (V1) возрастет и составит: V1 = k ∙ 1,2 ∙ 0,6 = k . 0,72/
Тогда: 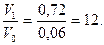
Следовательно, скорость реакции возрастет в 12 раз.
Пример 2. Определить, чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 50оС скорость реакции возрастает в 32 раза?
Решение. Согласно уравнению Вант-Гоффа:

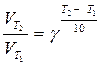 .
.
Подставим значения: 
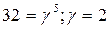 .
.
Пример 3.Определить, в сторону прямой или обратной реакции сместится равновесие в следующих системах:
1) 2Н2(г) + О2(г) ↔ 2Н2О(г); DНо298 = −483,6 кДж
2) СаСО3(к) ↔ СаО(к) + СО2(г) ; DНо298 = + 179 кДж
при: а) понижении температуры; б) повышении давления.
Решение. а). Согласно принципу Ле Шателье: понижение температуры приводит к смещению химического равновесия в сторону экзотермического процесса. Поскольку первая реакция – экзотермическая (∆Но < 0), то с понижением температуры произойдет сдвиг равновесия в сторону прямой реакции. Во второй – эндотермической реакции (∆Но > 0), наоборот – в сторону обратной.
б). С повышением давления по принципу Ле Шателье должно произойти смещение равновесия в сторону образования меньшего количества молей газообразных веществ (уменьшение объема газа). В первой – гомогенной системе – смещение равновесия произойдет в сторону прямой реакции (3 объема газа → 2 объема газа), а во второй – гетерогенной – в сторону обратной реакции (0 объемов газа → 1 объем газа).
Дата добавления: 2017-02-20; просмотров: 1265;
