Кинетика роста оксидных пленок
Кинетика газовой коррозии определяется главным образом свойствами оксидной пленки и температурой. Скорость газовой коррозии (r) обычно характеризуют зависимостью толщины оксидной пленки (d) от времени (t). Для газовой коррозии различают дифференциальную 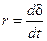 и интегральную d =f(t) форму кинетического уравнения.
и интегральную d =f(t) форму кинетического уравнения.
Газовая коррозия металла является гетерогенной химической реакцией: x Me (тв.) + y/2 O2 (газ) = MexOy (тв.), которая может протекать в кинетическом или диффузионном режимах. Соответственно законы изменения толщины пленки во времени для них будут различны.
Линейный закон роста пленки. При несплошной, пористой пленке оксида доступ молекул кислорода к поверхности металла свободен. Лимитирующей стадией коррозии является поверхностная химическая реакция, протекающая в условиях постоянства парциального давления кислорода и площади реакционной поверхности. В этом случае скорость коррозии определяется законом действующих масс:
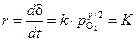 ,
,
где k – константа скорости реакции; 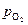 – парциальное давление кислорода; K – величина, постоянная для данной концентрации окислителя, включающая в себя площадь поверхности контакта «металл – газ» и парциальное давление кислорода.
– парциальное давление кислорода; K – величина, постоянная для данной концентрации окислителя, включающая в себя площадь поверхности контакта «металл – газ» и парциальное давление кислорода.
Постоянство скорости процесса газовой коррозии 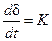 приводит к линейному закону роста толщины оксидной пленки (рис. 9.4):
приводит к линейному закону роста толщины оксидной пленки (рис. 9.4):
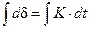 ® d ( t) = K t + const.
® d ( t) = K t + const.
Такому закону подчиняется газовая коррозия щелочных и щелочноземельных металлов.

Рис. 9‑4 Основные законы изменения толщины оксидных пленок d(t) во времени (t)
Примечание. Аналогичная линейная зависимость увеличения глубины коррозии (h) от времени наблюдается и у металлов, имеющих летучие оксиды, которые легко переходят в газовую фазу. Например, коррозия вольфрама и молибдена при относительно высоких температурах.
Параболический закон роста пленки.При наличии сплошной оксидной пленки лимитирующей стадией коррозии является процесс диффузии реагирующих частиц. Скорость коррозии определяется законами диффузии:
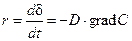 ,
,
где D – коэффициент диффузии, 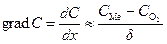 .
.
Поскольку самой медленной стадией коррозии является диффузия, то концентрация кислорода на внешней стороне оксидной пленки ( 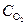 ) постоянна, а концентрация кислорода на поверхности металла (на внутренней поверхности пленки) примерно равна: СМе » 0. Тогда
) постоянна, а концентрация кислорода на поверхности металла (на внутренней поверхности пленки) примерно равна: СМе » 0. Тогда
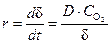
и, соответственно, 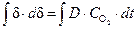 ®
® 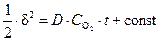 ,
,
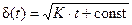 ,
,
где K=2×D× 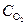 – величина постоянная для данной концентрации окислителя (рис. 9.4).
– величина постоянная для данной концентрации окислителя (рис. 9.4).
Параболический закон роста оксидной пленки наблюдается при окислении железа, меди, никеля и других металлов.
Для некоторых металлов (например, алюминий, хром) рост оксидной пленки происходит медленнее, чем это следует из диффузионного механизма. Это может быть объяснено протеканием при ее росте физико-химических процессов, замедляющих диффузию. В данном случае увеличение толщины оксидной пленки во времени можно описать логарифмическим законом:
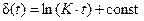 ,
,
где K – постоянная величина (рис. 9.4).
Необходимо отметить, что кинетический закон роста оксидной пленки зависит от внешних условий (температура и состав среды) и для данного металла может меняться.
Примечание. Во всех законах роста const = d(t=0) – начальная толщина оксидной пленки.
Дата добавления: 2017-02-20; просмотров: 2986;
