Термодинамические условия электрохимической коррозии металлов
Поскольку электрохимическая коррозия металлов – самопроизвольный процесс, то термодинамическим условием его протекания является уменьшение энергии Гиббса (DrG<0), которое можно оценить по знаку ЭДС (Е) коррозионного гальванического элемента (см. 8.1). Так как 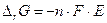 , то DrG<0, если E>0. Поскольку E = jк – jа, то условие самопроизвольного протекания реакции – jа<jк. При электрохимической коррозии на аноде происходит окисление металла, а на катоде протекают реакции восстановления водородного или кислородного электрода, следовательно, термодинамическое условие электрохимической коррозии –
, то DrG<0, если E>0. Поскольку E = jк – jа, то условие самопроизвольного протекания реакции – jа<jк. При электрохимической коррозии на аноде происходит окисление металла, а на катоде протекают реакции восстановления водородного или кислородного электрода, следовательно, термодинамическое условие электрохимической коррозии –
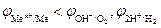 .
.
Сравнение электродных потенциалов кислородного и водородного электродов, величина которых зависит от pH электролита (см. рис.8.9), и потенциалов металлов позволяет определить термодинамическую возможность коррозии в различных средах. Для этого можно использовать величины стандартных электродных потенциалов металлов.
1. Если 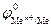 больше, чем потенциал кислородного электрода – областьIII (рис.8.9), то коррозия металла невозможна. Если
больше, чем потенциал кислородного электрода – областьIII (рис.8.9), то коррозия металла невозможна. Если 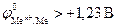 , то, независимо от величины pH, она не происходит. Например, золото не корродирует в обычных условиях, поскольку
, то, независимо от величины pH, она не происходит. Например, золото не корродирует в обычных условиях, поскольку 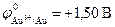 . Если
. Если 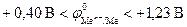 , то термодинамическая возможность коррозии зависит от величины pH.
, то термодинамическая возможность коррозии зависит от величины pH.
2. Если 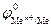 меньше, чем потенциал кислородного электрода, но больше, чем потенциал водородного электрода – область II (рис.8.9), то коррозия возможна только в присутствии в электролите растворенного кислорода. Электрохимическая коррозия металлов, у которых
меньше, чем потенциал кислородного электрода, но больше, чем потенциал водородного электрода – область II (рис.8.9), то коррозия возможна только в присутствии в электролите растворенного кислорода. Электрохимическая коррозия металлов, у которых 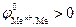 , протекает только с кислородной деполяризацией катода. Это наблюдается, например, для серебра
, протекает только с кислородной деполяризацией катода. Это наблюдается, например, для серебра 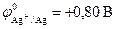 , меди
, меди 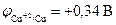 . Необходимо отметить, что эти металлы растворяются в кислотах, окислителях за счет иона Н+ только в присутствии растворенного в них кислорода.
. Необходимо отметить, что эти металлы растворяются в кислотах, окислителях за счет иона Н+ только в присутствии растворенного в них кислорода.
Электрохимическая коррозия металлов, у которых 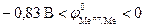 , может происходить с водородной деполяризацией катода в зависимости от величины pH и в отсутствие растворенного кислорода. Это наблюдается, например, для олова:
, может происходить с водородной деполяризацией катода в зависимости от величины pH и в отсутствие растворенного кислорода. Это наблюдается, например, для олова: 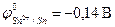 , железа:
, железа: 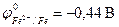 , цинка:
, цинка: 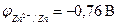 .
.
3. Если 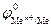 меньше, чем потенциал водородного электрода – область I (рис.8.9), то коррозия возможна как в присутствии растворенного кислорода с кислородной деполяризацией катода, так и в его отсутствие с водородной деполяризацией. Коррозия металлов, у которых
меньше, чем потенциал водородного электрода – область I (рис.8.9), то коррозия возможна как в присутствии растворенного кислорода с кислородной деполяризацией катода, так и в его отсутствие с водородной деполяризацией. Коррозия металлов, у которых 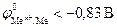 , возможна при любых величинах pH. Это наблюдается, например, для алюминия:
, возможна при любых величинах pH. Это наблюдается, например, для алюминия:  , магния:
, магния: 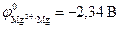 .
.
Отметим, что в присутствии в электролите растворенного кислорода большинство металлов корродирует с кислородной деполяризацией, поскольку коррозия с водородной деполяризацией катода менее вероятна. Термодинамическая возможность протекания коррозии часто не реализуется вследствие кинетических факторов.
Дата добавления: 2017-02-20; просмотров: 2221;
