Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Ме0 ® Ме+n + nē
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
а) 2H+ + 2ē ® H2 pH <7, б) О2 + 4H+ + 4ē ® 2H2 pH <7,
2H2O + 2ē ® H2 + 2OH- pH ³7 О2 + 2H2O + 4ē ® 4OH- pH ³7.
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Men+, OH- и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Ni2+ + 2OH- ® Ni(OH)2¯
Ni2+ + S2- ® NiS¯
2Cu2+ + СО2 + 4OH- ® (CuOH)2СО3¯ + H2O
4Fe(OH)2¯+ O2 + 2H2O ® 4Fe(OH)3¯
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H+½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что 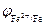 <
< 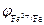 (см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода:
(см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода:
анод (Fe): Fe0 ® Fe2+ + 2ē
катод (Fe3C): 2H+ + 2ē ® H2
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe0 + 2H+ ® Fe2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 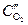 ) и меньше в центре (
) и меньше в центре ( 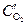 ). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).
). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).
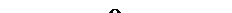
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 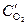 )): Cu0 ® Cu2+ + 2ē
)): Cu0 ® Cu2+ + 2ē
катод (Cu( 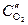 )): О2 + 2H2O + 4ē ® 4OH-
)): О2 + 2H2O + 4ē ® 4OH-
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Cu2+ +2OH- ® Cu(OH)2¯
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
2 Cu 2+ + СО2 + 4OH- ®(CuOH)2СО3¯ + H2O
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al0 ® Al3+ + 3ē
катод (Alсжат): 2H2O + 2ē ® H2 + 2OH-
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:
 Al3+ +3OH- ® Al(OH)3¯
Al3+ +3OH- ® Al(OH)3¯
Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 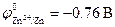 ;
; 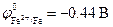 . Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
. Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
анод (Zn): Zn0 ® Zn2+ + 2ē
катод (Fe): О2 + 2H2O + 4ē ® 4OH-.
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Zn2+ +2OH- ® Zn(OH)2¯

Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
Дата добавления: 2017-02-20; просмотров: 11133;
