Развитие представлений о строении атома
К началу XIX века окончательно утвердилось понятие, что атом представляет наименьшую частицу вещества, являющуюся носителем его свойств. Именно на анализе изменения свойств атомов был основан целый ряд таблиц элементов, а в 1869 г. Дмитрием Ивановичем Менделеевым сформулирован Периодический закон.
Начиная с середины XIX века, росло число экспериментальных фактов, свидетельствовавших прямо или косвенно о сложном характере строения атома.
Уильям Крукс (Crookes) и позднее Джозеф Томсон (Thomson) обнаружили катодные лучи – поток электронов, возникающий между двумя электродами в вакууме при приложении к ним разности потенциалов.
Анри Беккерель (Becquerel) открыл явление естественной радиоактивности солей урана (a-, b- и g-излучение). Впоследствии было показано, что a-частицы это положительно заряженные ядра атомов гелия, b-частицы – поток электронов, аналогичный катодным лучам Крукса, g-излучение − поток квантов электромагнитного излучения, аналогичный X-лучам Рентгена.
Спектры излучения не взаимодействующих друг с другом свободных атомов представляют собой серии линий (узких полос) с определенными длинами волн (или соответственно частот), характерными для каждого атома. Для атомов водорода спектр излучения наиболее прост и состоит из ряда серий (исторически получивших имена Лаймана, Бальмера и др.) в видимой, УФ- и ИК-областях спектра. Была обнаружена эмпирическая формула зависимости, связывающей частоты излучения линий между собой:
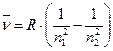 ,
,
где 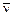 =1/l волновое число (характеристика, обычно используемая в спектроскопии); ni = 1,2,3 ,... (целые числа); R = 109677,58 см-1 – постоянная величина (постоянная Ридберга). Линейчатый характер спектров указывает на дискретный характер изменения энергии электронов в атоме.
=1/l волновое число (характеристика, обычно используемая в спектроскопии); ni = 1,2,3 ,... (целые числа); R = 109677,58 см-1 – постоянная величина (постоянная Ридберга). Линейчатый характер спектров указывает на дискретный характер изменения энергии электронов в атоме.
Эрнест Резерфорд (Rutherford) экспериментально установил, что атом состоит из малого по размеру положительно заряженного ядра, содержащего практически всю массу атома и расположенных вокруг него электронов, и предложил так называемую планетарную модель атома.
Работы Генри Мозли (Moseley) по изучению характеристических рентгеновских спектров различных элементов позволили доказать, что порядковый номер элемента в Периодической системе совпадает с зарядом ядра атома.
Таким образом, атом представляет собой сложную систему, состоящую из полжительно заряженного ядра движущихся вокруг него электронов. Заряд ядра атома (выраженный в единицах элементарного электрического заряда) соответствует порядковому номеру элемента в Периодической таблице и равен числу электронов.
Дата добавления: 2017-02-20; просмотров: 640;
