Химическая реакция.
Основные понятия химии.
ХИМИЯ − наука, изучающая строение веществ и их превращения, сопровождающиеся изменением состава или строения.
Все вещества состоят из атомов. Атом (от греч. ατομος − неделимый) − наименьшая химически неделимая часть веществ. Атом состоит из ядра и электронов. Ядро атома содержит положительно заряженные протоны и незаряженные нейтроны. Число отрицательно заряженных электронов в атоме совпадает с числом протонов. Химический элемент −совокупность атомов с одинаковым зарядом ядра. Каждый химический элемент имеет свое название и символ, которые приведены в Периодической системе элементов Дмитрия Ивановича Менделеева. Порядковый номер элемента в таблице совпадает с зарядом ядра и соответственно с числом протонов в нем.
Так как число протонов в ядре совпадает с числом электронов, заряды которых равны по величине и противоположны по знаку (±е), то атом в целом оказывается электрически нейтральным. Если из атома удалить или добавить электрон, возникают заряженная частица – положительно илиотрицательно заряженный ион: А − ē → А+ А + ē → А-.
В качестве единицы измерения заряда частиц (ядро, электрон, ион…) используют элементарный заряд е = 1,602·10-19 Кл.
Определенный атом обозначается символом, например, углерод С. Иногда дополнительно цифрами слева у символа указывают заряд ядра (порядковый номер) подстрочным индексом и массу атома (массовое число) надстрочным индексом, например, 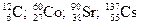 .
.
Для иона у символа атома надстрочным индексом справа указывается его заряд. Например, H+; Na+; Cu2+; Cl-; S2-.
Поскольку массы атомов чрезвычайно малы, то в качестве единицы измерения их массы принята атомная единица массы (а.е.м.), равная 1/12 массы атома углерода 12С (1 а.е.м.= 1,6605·10-27кг). В Периодической системе элементов указаны относительные атомные массы (Ar)элементов − безразмерные величины, показывающие во сколько раз масса данного атома больше 1/12 массы атома углерода 12С.
Редко встречаются вещества, у которых минимальной частицей, обладающей его химическими свойствами, является атом, для многих это молекула − частица, состоящая из двух и более одинаковых или разных атомов. Состав и порядок соединения атомов в молекуле при помощи символов передает химическая формула. В химической формуле справа у символа атома подстрочным индексом указывается их число в составе молекулы (отсутствие индекса – атом один).
Различают эмпирические, или брутто-формулы (показывают общее число атомов в молекуле), рациональные (в них выделяют группы атомов, характерные для данного класса соединений) и структурные (характеризуют порядок соединения атомов в молекуле).
Пример. Этиловый спирт:
брутто-формула C2H6O, молекула состоит из двух атомов углерода, шести атомов водорода и одного атома кислорода;
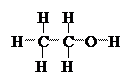 рациональная формула C2H5OH, группа OH-, характерная для спиртов и группа C2H5-;
рациональная формула C2H5OH, группа OH-, характерная для спиртов и группа C2H5-;
структурная формула порядок соединения атомов.
Относительная молекулярная масса вещества (Mr) − сумма относительных атомных масс (Ar)элементов, входящих в состав молекулы.
Пример. H2O Mr =2∙1+16=18 H2SO4 Mr =2∙1+32+4∙16=98
Pb(OH)2 Mr =207+2∙(1+16)=241
Примечание. Из молекул состоят газообразные вещества (при относительно низких температурах). Твердые кристаллические вещества имеют более сложное строение. Например, в кристаллах хлорида натрия нет молекул, они построены из равномерно чередующихся ионов Na+ и Cl-. В металлических или ковалентных кристаллах все атомы связаны друг с другом и нельзя выделить определенную молекулу, кристалл представляет собой «одну молекулу». В этих случаях говорят о формульной единице вещества − условной молекуле, которая имеет тот же качественный и количественный состав, что и вещество. Так для хлорида натрия формульная единица − NaCl, для металлов Al, Cu, Fe...
Подобно атомарным ионам существуют положительно илиотрицательно заряженные молекулярные ионы. Например, OH-; SO42-; PO43-; HCO3-; (CuOH)+; (CrOH)2+.
Химическая реакция.
Превращение (присоединение, разложение (диссоциация), обмен) одного или нескольких исходных веществ реагентов в отличающиеся от них по химическому составу или строению вещества (продукты реакции) называется химической реакцией.
Химическую реакцию записывают при помощи химических формул и численных коэффициентов в виде уравнения химической реакции. В левой части уравнения перечисляют через знак «плюс» формулы исходных веществ, в правой − продуктов реакции. При составлении уравнения химической реакции учитывают закон сохранения вещества:общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции. Количество молекул (молей) веществ участвующих в химической реакции − коэффициенты перед формулами (стехиометрические коэффициенты), подбирают так, чтобы сумма атомов одних и тех же элементов была одинаковой в левой и правой частях уравнения. Отсутствие коэффициента в уравнение говорит о его равенстве единице.
Пример.
Fe(OH)2 + 2HCl = FeCl2 + 2Н2О; H3PO4 + 3NaOH = Na3PO4 + 3Н2О;
Fe(OH)2 + HCl = (FeOH)Cl + Н2О; Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4
В случае составления уравнения химической реакции, в которой участвуют ионы, выполняется закон сохранения электрического заряда. Суммарный заряд частиц, образующих исходные вещества, равен суммарному заряду продуктов реакции (алгебраическая сумма зарядов частиц с учетом стехиометрических коэффициентов до реакции и после реакции равны).
Удобным модельным понятием является степень окисления атома. Степенью окисления называется формальный заряд атома элемента входящего в состав соединения, вычисленный их предположения, что гетероатомная молекула состоит из ионов. Он указывается цифрой над символом элемента. При определении степени окисления атома условились считать, что:
1. Степени окисления атомов, из которых состоят простые вещества, равны нулю. Пример: 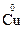 ,
, 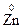 ,
, 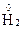 ,
, 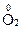 .
.
2. Степени окисления атомов в соединениях, состоящих из одноатомных ионов равны зарядам этих ионов. Пример: 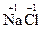 ,
, 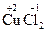 ,
, 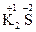 .
.
3. Степень окисления атомов водорода, входящих в состав сложных молекул или ионов равна +1. Пример: 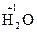 ,
, 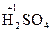 ,
, 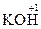 . Исключение - гидриды металлов, в которых она равна –1. Пример:
. Исключение - гидриды металлов, в которых она равна –1. Пример: 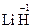 ,
, 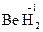 .
.
4. Степень окисления атомов кислорода, входящих в состав сложных молекул или ионов равна –2. Пример: 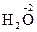 ,
, 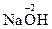 ,
, 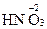 . Исключение - перекисные соединения, в которых она равна –1 и фторид кислорода +2. Примеры:
. Исключение - перекисные соединения, в которых она равна –1 и фторид кислорода +2. Примеры: 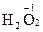 ,
, 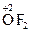 .
.
5. Алгебраическая сумма степеней окисления всех атомов элементов, входящих в состав молекулы равна 0, а входящих в состав иона равна его заряду.
Пример:
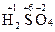
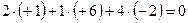 ;
; 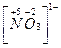
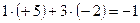
Различают два типа химических реакций:
1. Без изменения степеней окисления атомов, входящих в состав молекул – реакции присоединения, разложения (диссоциации), обменные реакции. Определение стехиометрических коэффициентов в них осуществляют обычно методом подбора.
2. С изменением степени окисления, атомов входящих в состав молекул – окислительно-восстановительные реакции. Для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций используют специальные методы (метод электронного и электронно-ионного баланса).
В окислительно-восстановительных реакциях изменение степеней окисления атомов происходит в результате перераспределения электронов между ними. Поэтому обязательно должны быть атомы, принимающие электроны − окислитель, при этом повышается их степень окисления, и атомы отдающие электроны − восстановитель, при этом их степень окисления понижается. Процесс приема электронов окислителем называется восстановлением, а отдачи электронов восстановителем − окислением. Понятия окислитель и восстановитель относятся также к ионам и молекулам.
Количество отданных электронов должно быть равно количеству принятых электронов. На основании баланса электронов можно получить стехиометрические коэффициенты в уравнении реакции.
Метод электронного баланса.
Пример. KClO3 + P = KCl + P2O5
1. Определение элементов (атомов), степени окисления которых изменяются в ходе реакции (Cl+5→ Cl-; P0→ P+5).
2. Составление баланса электронов, определение главных коэффициентов в уравнении реакции.
Cl+5 + 6 ē → Cl- ´5
2P0 − 10 ē →2 P+5 ´3
3. Подбор остальных коэффициентов и проверка правильности расстановки коэффициентов по балансу кислорода.
Пример. 5 KClO3 + 6 P = 5 KCl + 3 P2O5 15 О= 15 О
Для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водном растворе при участии ионов, используют метод электронно-ионного баланса. Особенно удобен этот метод, если известны не все продукты реакции.
Метод электронно-ионного баланса.
Пример. K2Cr2O7+Na2SO3+HNO3=Cr(NO3)3+Na2SO4+KNO3+H2O
1. Определение элементов (атомов), степени окисления которых изменяются в ходе реакции, и соответствующих им ионов. Обязательно должны быть (как минимум пара) элементы-окислители, у которых степень окисления понижается ( 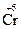 (Cr2O72-)→ Cr+3), и элементы-восстановители, повышающие степень окисления (
(Cr2O72-)→ Cr+3), и элементы-восстановители, повышающие степень окисления ( 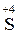 (SO32-)→
(SO32-)→ 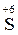 (SO42-)).
(SO42-)).
2. Составление полуреакций превращения ионов.
а) Материальный баланс (количество атомов до реакции и после должно быть одинаковым). При изменении количества атомов кислорода в составе реагирующих частиц, для их баланса используют молекулу H2O, ионы Н+ или ОН- в зависимости от характера среды в которой протекает реакция. При написании полуреакций используют следующие условные превращения:
| Кислая среда (Н+, H2O) | Щелочная среда (OН-, H2O) | Нейтральная среда (H2O) |
| «О» + 2Н+ = H2O | «О» + H2O = 2 ОН- | «О» + H2O = 2 ОН- |
| H2O = «О» + 2Н+ | 2 ОН- = «О» + H2O | H2O = «О» + 2Н+ |
б) баланс зарядов (суммарный заряд частиц с учетом участвующих электронов до и после реакции должен быть одинаковым).
Пример. Cr2O72- + 14 H+ +6 ē → 2 Cr+3 + 7 H2O ´1
SO32- + H2O − 2 ē → SO42- + 2 H+ ´3
3. Баланс электронов. Количество отданных электронов должно быть равно количеству полученных электронов (находят наименьшее общее кратное для количества отданных и полученных электронов и умножают каждую полуреацию на соответствующий сомножитель).
4. Сложение полуреакций с учетом всех коэффициентов.
Cr2O72-+14 H++6 ē+3SO32-+3 H2O−6 ē → 2 Cr+3+7 H2O+3 SO42-+6 H+
Сокращение одинаковых частиц до и после реакции.
Cr2O72-+8 H++3SO32- → 2 Cr+3+4 H2O+3 SO42-
5. Расстановка стехиометрических коэффициентов в уравнении реакции.
Пример. K2Cr2O7 + 3 Na2SO3+8 HNO3= 2 Cr(NO3)3+3 Na2SO4+2 KNO3+4 H2O
6. Проверка правильности расстановки коэффициентов по балансу кислорода (Пример. 40 O= 40 O).
Дата добавления: 2017-02-20; просмотров: 752;
