Количественные расчеты в химии.
При проведении химических реакций возникает вопрос о количественном соотношении реагирующих веществ. Если есть определенное количество вещества А, то необходимо знать сколько надо добавить вещества В и сколько при этом получится вещества АВ2 по реакции А + 2 В → АВ2. Точные данные о количественных соотношениях между реагирующими и получаемыми в результате реакции веществами содержит правильно написанное уравнение химической реакции.
Количество твердых веществ удобно характеризовать их массой (m), а газы и жидкости их объемом (V). В химии единицей измерения масса обычно служит грамм (г) и кратные ему величины, а единицей измерения объема литр (л) или миллилитр (мл≡см3).
Поскольку в химической реакции изменение количества реагирующих веществ происходит пропорционально числу молекул, а не массы веществ, то удобно измерять количество вещества в молях (ν). Моль − количество вещества, которое содержит столько формульных единиц (атомов, молекул, ионов или других частиц), сколько атомов содержится в 12 граммах изотопа 12C. Моль любого вещества содержит одинаковое число частиц, равное числу Авогадро (NА): 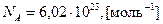 .
.
Масса одного моля вещества в граммах − молярная масса (М г/моль) - численно совпадает с относительной молекулярной Mr (атомной Ar) массой данного вещества. Количество вещества в молях можно рассчитать делением массы образца в граммах (m) на молярную (атомную) массу данного вещества: 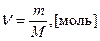 . Моль газообразного вещества при нормальных условиях (T=273 K и P=1013 гПа) занимает объем Vν =22,4 л/моль − молярный объем,
. Моль газообразного вещества при нормальных условиях (T=273 K и P=1013 гПа) занимает объем Vν =22,4 л/моль − молярный объем, 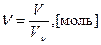 .
.
Например, в случае реакции нейтрализации гидроксида натрия и серной кислоты:
| 2 NaOH | + | H2SO4 | ® | Na2SO4 | + | 2 H2O |
| 2 моля | 1 моль | 1 моль | 2 моля | |||
| 2∙40 г | 98 г | 142 г | 2∙18 г | |||
| 178 г | = | 178 г |
2 моля щелочи взаимодействуют с 1 молем кислоты с образованием 1 моля соли и 2 молей воды. Можно выразить это же соотношение, переведя числа молей в единицы массы.
МNaOH = ( 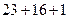 ) = 40 г/моль МH2SO4 = (
) = 40 г/моль МH2SO4 = ( 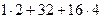 ) г = 98 г/моль
) г = 98 г/моль
МNa2SO4 = ( 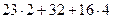 ) = 142 г/моль МH2O = (
) = 142 г/моль МH2O = ( 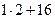 ) г = 18 г/моль
) г = 18 г/моль
Исходя из полученного соотношения, следует, что при осуществлении реакции на каждые 80 г гидроксида натрия необходимо добавить 98 г серной кислоты при этом получится 142 г соли и 36 г воды. Необходимо отметить, что выполняется закона сохранения вещества:общая масса веществ, вступающих в химическую реакцию (178 г), равна общей массе продуктов реакции (178 г).
Если задана масса одного из реагентов, то используя количественные соотношения заданные уравнением реакции можно определить массы остальных веществ.
Пример. Сколько граммов серной кислоты необходимо добавить к 1,6 г гидроксида натрия для полной нейтрализации щелочи?
| 2 NaOH | + | H2SO4 | ® | Na2SO4 | + | 2 H2O | |
| М, г/моль | |||||||
| ν, моль | 1,6/40 = 0,04 | 0,02 | 0,02 | 0,04 | |||
| m, г | 1,6 | 0,02∙98= 1.96 | 0,02∙142= 2.84 | 0,04∙18 0,72 |
Ответ: 1.96 г серной кислоты.
Взаимодействие растворов.
Уравнение реакции показывает соотношение количеств реагирующих веществ. В случае протекания реакций между растворами, для определения количества (масса или объем) взаимодействующих растворов необходимо учитывать содержание реагирующих веществ в растворе. Раствор состоит из растворенного вещества и растворителя, чаще всего это вода. Растворитель не расходуется при протекании реакции, поэтому при расчете количеств реагентов не учитывается.
Содержание вещества в растворе определяет концентрация. Чаще всего это массовая доля (w) и молярная концентрация (CM).
Массовая доля (w) – отношение массы растворенного вещества (m) к массе раствора (mp): w = 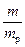 или w% =
или w% = 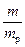
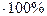 . Массовая доля, выраженная в процентах (w%), численно равна массе растворенного вещества в граммах, содержащейся в 100 г раствора. Соответственно, масса растворенного вещества, содержащегося в растворе – m = mp∙w.
. Массовая доля, выраженная в процентах (w%), численно равна массе растворенного вещества в граммах, содержащейся в 100 г раствора. Соответственно, масса растворенного вещества, содержащегося в растворе – m = mp∙w.
Молярная концентрация (CM) (молярность раствора) – количество растворенного вещества в молях, содержащегося в 1 литре раствора: 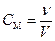 , размерность [моль/л]. Количество молей растворенного вещества в растворе – ν = CM∙V, где V объем раствора в литрах. Возможно другое обозначение молярной концентрации CM, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л − раствор 0,5 М.
, размерность [моль/л]. Количество молей растворенного вещества в растворе – ν = CM∙V, где V объем раствора в литрах. Возможно другое обозначение молярной концентрации CM, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л − раствор 0,5 М.
Пример 1. Какой объем 5% раствора HCl r=1,023 г/см3 необходим для полного осаждения серебра в виде AgCl из 500 мл раствора AgNO3 концентрации 0,01 моль/л?
Решение.
Уравнение реакции HCl + AgNO3 ↔ AgCl¯ + HNO3
1 моль 1 моль 1 моль 1 моль
1. Раствор AgNO3 V = 500 мл = 0,5 л; молярная концентрация CM = 0,01 моль/л; количество растворенной соли ν = CM∙V = 0,01 моль/л × 0,5 л = 0.005 моля AgNO3.
2. Согласно уравнению реакции (1 моль AgNO3 реагирует с 1 молем HCl) для полного осаждения необходимо ν = 0.005 моль HCl. Молярная масса М = (1+35,5) = 36,5 г/моль, следовательно, требуется m = ν∙М = 0,005×36,5=0,183 г вещества HCl.
3. Масса 5% раствора HCl (w = 0,05), содержащая 0,183 г равна mp=m/w=0,183/0,05=3,66 г.
4. Плотность раствора кислоты r=1,023 г/см3, следовательно, объем раствора V = mp/r =3,66/1,023 =3,6 см3 (мл).
Ответ: Для полного осаждения ионов серебра необходимо 3,6 мл 5% раствора HCl.
Пример 2. Какой объем углекислого газа (CO2) можно получить из 60 г карбоната кальция (CaCO3) при его взаимодействии с раствором соляной кислоты (HCl) концентрации 2 моль/л? Сколько раствора кислоты для этой реакции потребуется?
Решение.
Уравнение реакции CaCO3 + 2 HCl ↔ CO2↑ + CaCl2 + H2O
1 моль 2 моля 1 моль 1 моль
1. Молярная масса CaCO3 М = (40+12+3∙16) = 100 г/моль, следовательно, количество CaCO3 равно ν = m/М = 60/100 = 0,6 моль.
2. Согласно уравнению реакции (1 моль CaCO3 реагирует с 2 молями HCl и получается 1 моль CO2) необходимо ν = 0,6∙2 = 1,2 моля вещества HCl и получится ν = 0,6 моля CO2.
3. Объем, полученного углекислого газа, V = ν∙Vν =0,6∙22,4 = 13,4 л, где Vν = 22,4 л/моль – молярный объем газов.
4. Поскольку необходимо ν =1,2 моля вещества HCl, то объем раствора кислоты равен V = ν/CМ = 1,2/2 =0,6 л, где CМ = 2 моль/л молярная концентрация раствора.
Ответ: Получится 13,4 л углекислого газа, а для реакции потребуется 0,6 л раствора HCl концентрации 2 моль/л.
Примечание. Для количественных расчетов можно использовать понятие эквивалент. Вещества реагируют в эквивалентных количествах – один эквивалент реагирует с одним эквивалентом.
Эквивалент − реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна иону водорода (Н+) в обменных или электрону в окислительно-восстановительных реакциях. Масса эквивалента вещества в z раз меньше массы его моля, где z – эквивалентное число ( 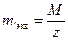 ;
; 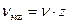 ). Для кислот и оснований эквивалентное число равно числу ионов Н+ или OH- соответственно, которыми они участвуют в реакции. Для окислителя и соответственно восстановителя z равно числу отданных или полученных электронов.
). Для кислот и оснований эквивалентное число равно числу ионов Н+ или OH- соответственно, которыми они участвуют в реакции. Для окислителя и соответственно восстановителя z равно числу отданных или полученных электронов.
Нормальная концентрация (CN) (молярная концентрация эквивалентов) − количество молей эквивалентов вещества в 1 литре раствора. Размерность [моль-экв/л], CN = z∙CМ. Количество молей эквивалентов растворенного вещества в растворе – νэкв = CN ∙V, где V объем раствора в литрах.
Строение вещества
СТРОЕНИЕ АТОМА
Химия – фундаментальная отрасль естествознания, наука о веществах и законах их превращения, при которых молекулы одного соединения обмениваются атомами с молекулами других соединений, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции, в результате которых образуются новые вещества.
В химических процессах у атомов претерпевают изменения лишь наружние электронные оболочки; ядро и внутренние оболочки при этом не изменяются, поэтому для курса химии теория строения атома есть в первую очередь рассмотрение способов описания состояния электронов (энергия и нахождение электрона в пространстве).
Дата добавления: 2017-02-20; просмотров: 3328;
