Теория строения атома Бора
Первой моделью атома, в которой были использованы идеи квантования энергии, стала теория Нильса Бора (Bohr), разработанная на базе модели Резерфорда.
Основным недостатком планетарной модели строения атома Резерфорда было ее противоречие теории классической электродинамики, которая утверждает, что, двигаясь по круговой орбите, электрон как заряженная частица должен непрерывно излучать энергию и "достаточно быстро упасть на ядро". Нильс Бор пришел к выводу, что микрочастицы отличаются по свойствам от макрообъектов, поэтому классической электродинамики недостаточно для их описания. В своей теории Бор использовал представления классической механики о движении заряженной частицы в электрическом поле, дополнив их идеями квантования энергии. При этом он выдвинул три постулата (постулат – утверждение в теории, принимаемое за истинное, хотя и недоказуемое в рамках этой теории).
Первый постулат. Электроны в атоме могут двигаться только по некоторым определенным устойчивым стационарным круговым орбитам. При движении по этим орбитам электроны не излучают энергию, то есть существует ряд стационарных состояний атома, соответствующих определенным значениям его энергии.
Второй постулат.При переходе электрон с одной стационарной орбиты на другую атом испускает или поглощает квант электромагнитного излучения, энергия которого (hn) равна разности энергий стационарных состояний:
hn=E1–E2,
где h – постоянна планка, n – частота излучения.
Третий постулат. В атоме существуют только такие электронные орбиты, находясь на которых электрон обладает моментом количества движения, кратным 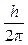 (часто вводят обозначение
(часто вводят обозначение 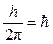 ):
):
M = m×v×r = 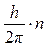 ,
,
где M – момент количества движения электрона; m = 9,11×10-31 кг – масса электрона; v – скорость электрона; r – радиус орбиты электрона; h = 6,63×10-34 Дж×с – постоянная Планка; n = 1,2,3 ... – целое число, получившее название «квантовое число».
Используя эти постулаты, Бор рассчитал размеры стационарных орбит электронов в атоме, энергию электронов на стационарных орбитах и выразил постоянную Ридберга через основные константы.
Так, в этой модели атом водорода представляет собой положительно заряженное ядро, вокруг которого по круговой орбите движется электрон. Используя представления классической механики о движении частицы по круговой орбите и постулаты Бора можно определить энергию электрона и радиус его орбиты.
Радиусы электронных орбит: 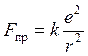 – сила кулоновского притяжения; k = 1/4pe0, e0= 8.85×10-12 Кл/Н×м2 – электрическая постоянная; е = 1.6×10-19 Кл – единичный электрический заряд (заряд ядра и электрона)
– сила кулоновского притяжения; k = 1/4pe0, e0= 8.85×10-12 Кл/Н×м2 – электрическая постоянная; е = 1.6×10-19 Кл – единичный электрический заряд (заряд ядра и электрона) 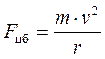 – центробежная сила;
– центробежная сила; 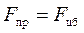 ;
; 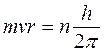 – постулат Бора;
– постулат Бора; 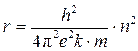 – радиусы орбит электрона; n = 1,2,3... – квантовое число.
– радиусы орбит электрона; n = 1,2,3... – квантовое число.
Радиус первой (n=1) стационарной орбиты электрона для атома водорода составляет величину:
r1 = h2/4p2e2mk= 5,29×10-11 м≈0,53 Å
и называется «радиус первой боровской орбиты» (1Å = 10-10 м).
Энергия электрона: 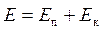 – полная энергия электрона;
– полная энергия электрона; 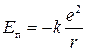 – потенциальная энергия электрона;
– потенциальная энергия электрона; 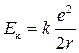 – кинетическая энергия электрона;
– кинетическая энергия электрона; 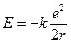 – полная энергия электрона;
– полная энергия электрона; 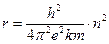 – радиус орбит электронов;
– радиус орбит электронов; 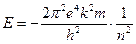 .
.
Электрон, находящийся на первой стационарной орбите (n=1) атома водорода, будет обладать энергией
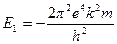 = –2,17×10-18 Дж = – 13,6 эВ; (1эВ=1,602×10-19Дж).
= –2,17×10-18 Дж = – 13,6 эВ; (1эВ=1,602×10-19Дж).
Отрицательное значение энергии свидетельствует о том, что электрон связан с ядром. Для перевода электрона на бесконечное расстояние от ядра (удаление из атома) необходимо затратить энергию, называемую энергией ионизации (Eи). Численное значение энергии электрона в основном состоянии атома водорода (E1) совпадает с экспериментально определенной величиной Eи.
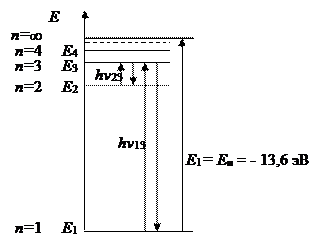 Набор стационарных орбит электрона может быть представлен в виде набора энергетических состояний (уровней) – рис. 2.1. При переходе электрона с более удаленной стационарной орбиты на менее удаленную энергия выделяется в виде квантов электромагнитного излучения. При поглощении энергии электрон переходит на более удаленные орбиты.
Набор стационарных орбит электрона может быть представлен в виде набора энергетических состояний (уровней) – рис. 2.1. При переходе электрона с более удаленной стационарной орбиты на менее удаленную энергия выделяется в виде квантов электромагнитного излучения. При поглощении энергии электрон переходит на более удаленные орбиты.
Рис. 2‑1 Диаграмма энергетических состояний электрона в атоме водорода: n – главное квантовое число; Еi – энергия электрона на i орбите; hnij = Ei - Ej – квант электромагнитного излучения
Квантовое число n определяет энергию электрона и радиус орбит, по которым двигается электрон, обладающий соответствующей энергией.
Теория Бора сыграла положительную роль, открыв дорогу квантовой механике. Основное ее достоинство заключалось в количественном описании линейчатых спектров простейших атомов. С усовершенствованием приборов и техники спектроскопии обнаружили, что линии, принимавшиеся за единичные, в действительности состоят из нескольких близко расположенных друг к другу линий. Следовательно, для каждого квантового числа существует несколько близких друг к другу энергетических уровней. До некоторой степени это объяснил Арнольд Зоммерфельд (Sommerfeld), который допустил существование в атоме эллиптических орбит. Было введено еще два дополнительных квантовых числа: побочное и магнитное, существование которых непосредственно не вытекало из теории Бора. Однако в целом необходимо констатировать, что в рамках классической физики не удалось создать "хорошую" модель описания поведения микрочастиц. Основным недостатком теории Бора для химии явилась невозможность дать даже качественное и тем более количественное описание химической связи.
Дата добавления: 2017-02-20; просмотров: 6325;
