Метод дипольных моментов в химии
Лекция посвящена одному из важнейших физических методов исследования строения вещества – методу дипольных моментов.
1. Общие представления о природе дипольного момента
Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы.
Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле.
Величина электрического дипольного момента (μ) определяется соотношением:
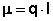 (1)
(1)
где l - радиус-вектор, направленный от центра тяжести отрицательного электрического заряда к центру тяжести положительного заряда, абсолютная величина каждого заряда равна q. В химической литературе, так же как и в настоящей лекции, принято противоположное направление вектора дипольного момента. По порядку величины дипольный момент в системе CGSE равен заряду электрона (4.8·10-10 эл.-ст. ед.), умноженному на расстояние в 1Å (10-8 см), что составляет 4.8·10-18 эл.-ст. ед. Принято измерять дипольные моменты в единицах Дебая: 1 D = 1·10-18 эл.-ст. ед. В системе единиц СИ 1 D = 3.34·10-30 Кл*м.
Причиной появления дипольного момента являются несколько факторов. В первую очередь – это различия в природе составляющих молекулу атомов. В простейшем случае для двухатомной молекулы μ=0, если она состоит из двух одинаковых атомов. Это относится к H2, O2, N2 и т.д. В двухатомной молекуле с атомами разной природы проявляется постоянный дипольный момент, т. к., вследствие разной электроотрицательности, характеризующей способность атома оттягивать электронную плотность, появляется асимметрия электронной плотности. Другие причины – разные гибридные состояния орбиталей атомов. Так, например, для связи H-Cl, образованной 1s-орбиталью водорода и 3p-орбиталью хлора, вследствие различной формы s- и p-орбиталей, центр тяжести заряда перекрывания смещен в сторону водорода на ΔL, за счет чего возникает дополнительный, т. н. гомеополярный дипольный момент (рис.1):
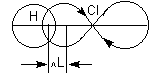
Рис. 1. Схема происхождения гомеополярного диполя.
Естественно, молекулы HCl, HBr, HI имеют постоянные дипольные моменты, равные, соответственно, 1.95 D, 0.79 D, 0.40 D. Другие вклады в суммарный дипольный момент возникают из-за асимметрии связывающей и несвязывающей атомных орбиталей вследствие их гибридизации. Так, дипольный момент аммиака, 1.46 D, в основном обусловлен моментом несвязывающей пары электронов азота.
Дата добавления: 2018-03-01; просмотров: 686;
