Расчетный аппарат метода дипольных моментов
Исследование большинства структурных проблем, проводимое с помощью данных о дипольных моментах молекул, основывается на сопоставлении экспериментальных величин дипольных моментов с величинами, рассчитанными по аддитивной схеме. Принципиальная идея последней была предложена в 1923 году Томсоном, который указал, что дипольный момент многоатомной молекулы m можно рассматривать как результат векторного сложения дипольных моментов, принадлежащих отдельным связям. Для молекулы, содержащей n связей различных типов,
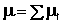 (6)
(6)
где μi – момент, характеризующий i-ю связь.
Дипольные моменты связей и групп, в свою очередь, находят или путем теоретической оценки из квантово-химических расчетов, или полуэкспериментальными методами из интенсивностей колебательных полос поглощения, либо путем векторного сложения дипольного момента некоторых симметричных молекул. В последнем случае уравнение (6) может быть использовано для решения обратной задачи: разложения суммарного дипольного момента на составляющие. Например, моменты связей H-O и H-N можно вычислить из значений дипольных моментов воды и аммиака соответственно:
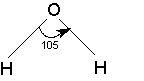
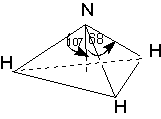
2 μO-H cos 52° = 1.84 D. 3 μN-H cos 68° = 1.46 D.
μO-H = 1.51 D. μN-H =1.31 D.
Основой системы дипольных моментов связей является величина момента связи C-H метильной группы, которая, по расчитанным и экспериментальным данным, в том числе и по данным ИК-спектров, была принята за величину, близкую к 0.4 D. Вместе с тем, всегда следует учитывать гибридное состояние атома углерода, при котором находится протон. По данным ИК-измерений были установлены следующие значения моментов связей: Csp3 – H+ = 0.31D; Csp2 – H+ = 0.63 D; Csp– H+=1.05 D. Соответственно будут меняться моменты связей С-С с различными гибридными состояниями атома углерода и дипольные моменты молекул в целом. Во многих случаях удобнее пользоваться не моментами связей, а моментами отдельных групп. Например, при анализе дипольного момента ароматических нитросоединений нет необходимости учитывать отдельные моменты связей C-N, N=O, N→O, а целесообразно ввести результирующую величину группового момента μNO2. При этом μNO2 принимается равным дипольному моменту бензола и, следовательно, является фактически суммой моментов нитрогруппы и C-H-связи в п-положении. Это очень удобно, т. к. позволяет исключить введение в расчеты в явном виде моментов связей C-H. Действительно, дипольный момент м-нитробензола, например, можно рассчитать просто как векторную сумму двух моментов μNO2.
Имеются таблицы групповых моментов, где за величину группового момента в ароматическом ряду принимается значение дипольного момента монозамещенного бензола, а в алифатическом – соответствующего монозамещенного метана. В таблице 2 в качестве примера приведены лишь некоторые групповые моменты.
Таблица 2. Групповые моменты (бензол, 25 С).
| Группа X | μC6H5-X, D | Θ, град | μCH3-X, D | Θ, град |
| CH3 | 0.37 | |||
| CF3 | -2.54 | -2.32 | ||
| CCl3 | -2.04 | -1.57 | ||
| F | -1.47 | -1.79 | ||
| Cl | -1.59 | -1.87 | ||
| OH | 1.55 | --- | --- | |
| OCH3 | 1.28 | 1.28 | ||
| NO2 | -4.01 | -3.10 |
Θ - угол между вектором группового момента и связью Х-С.
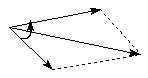
Групповые моменты часто используются в расчетах для различных целей. Для молекул, содержащих две жестко закрепленные полярные группы, расчет дипольного момента молекулы (μ) сводится к сложению двух векторов(μ1 и μ2), находящихся друг к другу под некоторым углом φ:
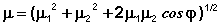 (7)
(7)
Более сложным метод расчета выглядит для молекул, содержащих произвольное число жестко закрепленных полярных групп. Для них чаще всего применяется способ расчета через проекции вектора дипольного момента на произвольно выбранные оси координат (8):
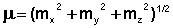 (8)
(8)
При этом под mx, my, mz подразумеваются суммы проекций на эту ось векторов всех групповых моментов. В качестве примера рассмотрим расчет дипольного момента 4,5-дихлор-1,3-бис-трифторметил-бензола:
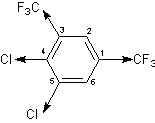
CF3 (1) mx = 2.54 *; my = 0.
CF3 (3) mx = -2.54 cos 60º; my = 2.54 sin 60º.
Cl (4) mx = -1.59; my = 0.
Cl (5) mx = -1.59 cos 60º; my = -1.59 sin 60º.
------------------------------------------------------------
Σ mxi = -1.12 D. Σ myi = 0.83 D.
μвыч = [ (-1.12)2 + 0.832 ]1/2 = 1.40 D
* Положительное значение m связи указывает на то, что m связи направлен по оси координат, а отрицательное – против.
Опытные значения по различным источникам составляют 1.51-1.62 D.
Естественно, если молекулы неплоские, то следует найти проекции векторов на соответствующие плоскости. Существенно усложняется расчет, если молекула содержит несколько свободно или заторможенно вращающихся полярных групп. Здесь применяются специальные подходы, описанные в монографиях.
Если молекулы некоторых соединений существуют в растворах или в газовой фазе в виде равновесной смеси двух или нескольких молекулярных форм: таутомеров, конформеров, мономеров и димеров, то экспериментально определяемый дипольный момент является в этом случае усредненной величиной. связанной с дипольными моментами индивидуальных форм соотношением (9):
 (9)
(9)
где Ni и μi – соответственно мольные доли и дипольные моменты таутомера, конформера и др.
Расчет по формуле (9) можно иллюстрировать примером вычисления эффективного дипольного момента 2,5-диметокси-нитробензола, для которого показана возможность существования в растворе четырех равновероятных плоских конформаций I - IV:
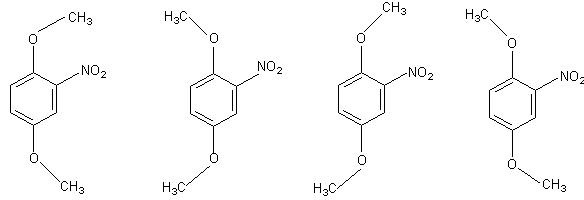
μвыч = 3.47 D. μвыч = 5.59 D. μвыч = 4.01 D. μвыч = 4.01 D.
I II III IV
Воспользовавшись значениями групповых моментов из таблицы 2 и рассчитав теоретические величины дипольного момента каждого конформера, получим:
μ2 = 0.25 (3.47)2 + 0.25 (5.59)2 + 0.25 (4.01)2 + 0.25 (4.01)2
μ = 4.34 D.
Полученное значение близко к опытной величине 4.56 D (бензол, 18 °С)
Дата добавления: 2018-03-01; просмотров: 1605;
