АНАБОЛИЗМ НУКЛЕИНОВЫХ КИСЛОТ
Исходными веществами для биосинтеза молекул ДНК служат дезокси-
Рисунок 4.12 - Катаболизм пуриновых оснований
              
Рисунок 4.13 - Катаболизм пиримидиновых оснований
|
рибонуклеозид-5'-трифосфаты, а специфическое расположение нуклеотидных остатков в молекулах ДНК обеспечивается взаимодействием комплементарных оснований, принадлежащих, с одной стороны, полинуклеотидной матрице, а с другой — нуклеозидтрифосфатам. Аналогично идет специфический биосинтез РНК из рибонуклеозидтрифосфатов на ДНК-матрице.
Из трех основных частей нуклеотида (азотистого основания, фосфорной кислоты и пентозы) фосфорная кислота всегда присутствует в клетках, рибоза образуется при распаде углеводов, и только гетероциклическое основание создается специфическим путем.
Пути синтеза пуриновых и пиримидиновых оснований различны. Но есть некоторые сходные черты в механизмах синтеза пуринового и пиримидинового циклов:
использование глицина, аспарагина и глутамина в качестве источников азота гетероциклических колец;
включение в состав пуриновых и пиримидиновых циклов атомов углерода углекислого газа и муравьиной кислоты;
построение пуринового основания и завершение синтеза пиримидинового основания на рибозо-5-фосфате, в результате чего конечными продуктами биосинтеза являются сразу нуклеозид-5'-фосфаты;
ферментативный характер всех реакций, осуществляющихся в процессе синтеза нуклеотидов;
возникновение на определенном этапе биосинтеза общих предшественников (инозин-5'-монофосфата — для пуриновых нуклеотидов, уридин-5'-монофосфата — для пиримидиновых).
Как видно на схеме, два атома азота пуринового кольца происходят из амидной группы глутамина, третий атом азота — из аспартата (аспарагиновой кислоты) и, наконец, четвертый — из глицина. Четвертый и пятый атомы углерода также происходят из глицина. Таким образом, молекула глицина дает три атома. Второй и восьмой атомы углерода происходят из формиата (муравьиной кислоты), а шестой атом углерода — из СО2:










Формирование пуринового кольца сразу идет на рибозо-5-фосфате, и в результате последовательных реакций наращивания пуринового цикла образуется инозин-5'-монофосфат (ИМФ) — ключевое соединение в синтезе пуриновых нуклеотидов. Инозин-5'-фосфат способен окисляться в ксантозин-5'-фосфат.
В результате аминирования инозин-5'-монофосфата синтезируется аденозин-5'-монофосфат (АМФ), а из АМФ при восстановлении — дезоксиаденозин-5'-монофосфат (dАМФ). Ксантозин-5'-монофосфат (КМФ) превращается в гуанозин-5'-монофосфат (ГМФ) путем аминирования.
В процессе синтеза пиримидиновых оснований один атом азота цикла пиримидина происходит из аммиака, атом углерода — из углекислого газа, а второй атом азота и остальные атомы углерода — из аспарагиновой кислоты. В результате последовательных реакций наращивания пиримидинового цикла при дальнейшем участии фосфорилированной рибозы образуется уридин-5'-монофосфат (УМФ) — ключевое соединение в биосинтезе пиримидиновых нуклеотидов.
Уридин-5'-монофосфат далее превращается в цитидин-5'-мо-нофосфат (ЦМФ), а также в дезоксиуридин-5'-монофосфат (dУМФ) и дезокситимидин-5'-монофосфат (dТМФ).
Пуриновые и пиримидиновые нуклеозид-5'-монофосфаты (НМФ и dНМФ) превращаются в макроэргические нуклеозид-5'-дифосфаты (НДФ и dНДФ), которые далее переходят в богатые энергией нуклеозид-5'-трифосфаты (НТФ и dНТФ). Процессы фосфорилирования нуклеотидов идут при их взаимодействии с универсальным источником энергии АТФ при участии специфических фосфотрансфераз (киназ).
Синтез дезоксирибонуклеозид-5'-трифосфатов (dНТФ) осуществляется посредством реакции восстановления рибозы по гидроксильной группе при втором углеродном атоме. Эта реакция свойственна как нуклеозидмонофосфатам, так и нуклеозиддифосфатам.
Биосинтез всех дезоксирибонуклеозид-5'-трифосфатов и рибонуклеозид-5'-трифосфатов регулируется в клетке таким образом, что они возникают зависимо друг от друга в строго определенных соотношениях.
ОБМЕН ЛИПИДОВ
Жиры — основной источник энергии в организме. Жиры значительно превосходят по энергетической ценности углеводы и в значительных количествах могут запасаться в качестве «резервного топлива».
Характерным структурным компонентом большинства липидов являются высшие жирные кислоты. В состав жиров чаще всего входят кислоты с 16— 18 атомами углерода, среди них имеются насыщенные и ненасыщенные высшие жирные кислоты.
КАТАБОЛИЗМ ЛИПИДОВ
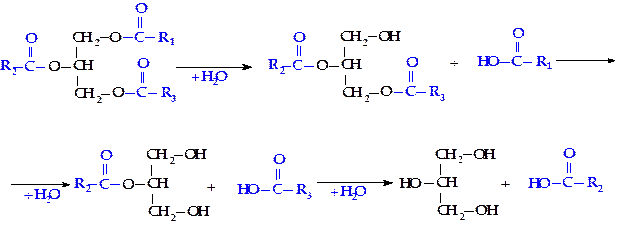
Распад жиров (триглицеридов) начинается с их гидролиза, в результате чего образуются глицерин и высшие жирные кислоты. Гидролиз триглицеридов, входящих в состав пищи, у высших животных происходит преимущественно в тонком кишечнике и катализируется липолитическими ферментами — панкреатическими липазами, вырабатываемыми поджелудочной железой.
Эти ферменты бывают двух типов: одни из них специфичны в отношении эфирных связей в a-положении триглицерида, другие гидролизуют связи в b-положении.
Полный гидролиз триглицеридов идет ступенчато: сначала быстро гидролизуются a-связи, а потом уже идет медленный гидролиз b-моноглицерида:
Глицерин независимо от того, поступит ли он на ресинтез жиров или будет претерпевать дальнейший распад, прежде всего фосфорилируется. Донором остатка фосфорной кислоты в этой реакции служит АТФ. Образующийся фосфоглицерин в основном расходуется на синтез новых молекул триглицеридов, но часть его окисляется с образованием диоксиацетонфосфата.
Диоксиацетонфосфат изомеризуется в 3-фосфоглицериновый альдегид, который затем вступает в обменные реакции.
Высшие жирные кислоты распадаются преимущественно путем b-окисления, получившего такое название потому, что в молекуле жирной кислоты оксиление протекает по b-углеродному атому, при этом от кислоты отщепляется двууглеродный фрагмент. Ненасыщенные высшие жирные кислоты (олеиновая, линолевая, линоленовая и др.) предварительно восстанавливаются до предельных кислот. Окисление предельных высших жирных кислот осуществляется ступенчато. Все реакции многостадийного окисления ускоряются специфическими ферментами. b-Окисление высших жирных кислот у млекопитающих происходит во многих тканях, в первую очередь в печени, почках и сердце.
Первым этапом b-окисления высших жирных кислот является их активирование путем образования соединения с коэнзимом А (HS-КоА). Эта реакция протекает в цитоплазме с использованием энергии АТФ и приводит к образованию ацилкоэнзима А (ацил-SКоА). Взаимодействие высших жирных кислот с коэнзимом А ускоряется специфическими лигазами — ацил-SКоА-синтетазами:
С17Н35-СООН + HS-KoA + АТФ ¾¾¾® С17Н35-СО~ S-KoA + АМФ + ФФн
Вторая стадия распада высших жирных кислот состоит в окислении ацилкоэнзима А при посредстве ацил-SКоА-дегидрогеназы, содержащей ФАД+ в качестве кофермента (рисунок 4.14, реакция 1).
Третья стадия окисления высших жирных кислот состоит в присоединении молекулы воды (гидратация) по месту двойной связи дегидроацил-КоА. Эта реакция ускоряется соответствующими гидролиазами (еноил-SКоА-гидратазами) (реакция 2).
Четвертая стадия распада высших жирных кислот заключается в их новом окислении путем отнятия двух атомов водорода (дегидрирование) в b-положении по отношению к карбоксильной группе (реакция 3). Реакция катализируется оксидоредуктазой, но (в отличие от первой стадии окисления) с участием НАД+ в качестве кофермента.
Пятая стадия распада заключается в переносе b-кетоацил-SКоА-ацильной группировки на новую молекулу коэнзима А. Этот процесс ускоряется соответствующей ацилтрансферазой, называемой тиолазой, поскольку реакция по существу представляет расщепление связи -С—С- с присоединением по месту разрыва элементов HS-группы (тиолиз или тиолитическое расщепление) (реакция 4).
В результате описанных выше реакций молекула высшей жирной кислоты (стеариновой в рассматриваемом примере) укорачивается на два углеродных атома, и образуются пальмитиновая и уксусная кислоты в виде производных коэнзима А (пальмитил- и ацетил-SКоА). Этот процесс многократно повторяется. Так, пальмитил-SКоА снова дегидрируется, затем гидратируется, еще раз дегидрируется и расщепляется на С13Н27-CO~S-KoA и новую молекулу ацетил-SКоА. В свою очередь C13H27-CO~S-KoA дает С11Н23-CO~S-КоА и еще молекулу ацетил-SКоА и т.д. (рисунок 4.14).
Окончательным продуктом b-окисления высших жирных кислот в организме является ацетил-SКоА.

| -обозначает
повторение
реакций 1-4
| |




| тиолитическое расщепление
| |
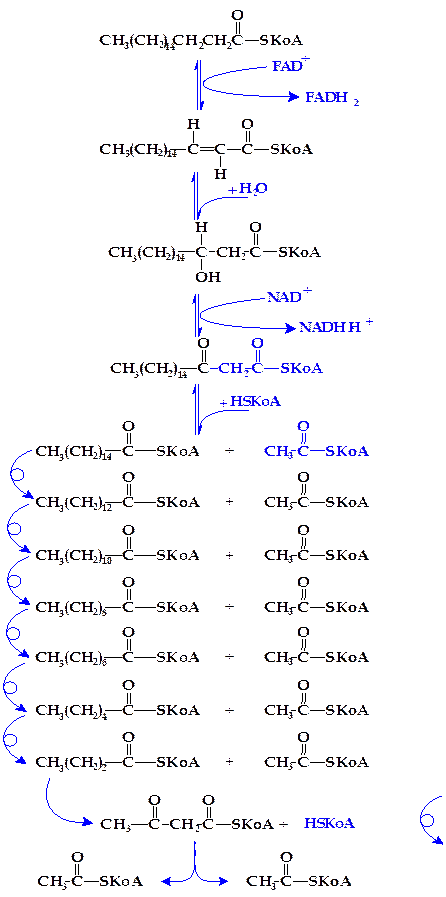
Рисунок 4.14 - Реакции b-окисления жирных кислот
(на примере стеариновай кислоты)
b-Окисление высших жирных кислот протекает в митохондриях, в липопротеидной мембране которых расположены ансамбли ферментов, обеспечивающих ряд индивидуальных реакций, составляющих процесс b-окисления. Поскольку в митохондриях локализованы также ферменты дыхательного цикла, ведущие передачу атомов водорода и электронов на кислород сопряженно с окислительным фосфорилированием, b-окисление высших жирных кислот является источником энергии для синтеза АТФ.
В процессе распада пальмитиновой кислоты проходит 7 циклов b-окисления, в каждом из которых образуются 5 молекул АТФ (посредством восстановленных ФАДН2 и НАДН.Н+).
При окислении пальмитата до ацетил-SКоА образуются 35 молекул АТФ. Восемь молекул ацетил-SКоА дают в результате полного сгорания в цикле Кребса 8 . 12 = 96 молекул АТФ. Одна молекула АТФ затрачивается на активирование пальмитата. Следовательно, энергетический эффект составляет 130 молекул АТФ.
Если бы ацетил-SКоА накапливался в организме, то запасы HS-КоА быстро исчерпались бы, и окисление высших жирных кислот остановилось. Этого не происходит, так как HS-КоА быстро освобождается из состава ацетил-SКоА в результате следующих процессов:
¾ ацетил-SКоА включается в ЦТК, где окисляется до СО2 и Н2О;
¾ ацетил-SКоА используется для синтеза полициклических спиртов (стеролов) и соединений, содержащих изопреноидные группировки;
¾ ацетил-SКоА является универсальным донором ацетильных групп для реакций ацетилирования (синтез ацетилхолина, N-ацетилглюкозамина и т.п.).
Основная масса природных липидов содержит жирные кислоты с четным числом атомов углерода. Однако в липидах растений инекоторых морских организмов присутствуют жирные кислоты с нечетным числом атомов углерода в цепи. Кроме того, у жвачных животных, в процессе переваривания углеводов в рубце образуется большое количество пропионовой кислоты, которая содержит три атома углерода. Жирные кислоты с нечетным числом атомов углерода окисляются таким же образом, что и кислоты с четным числом атомов, с той лишь разницей, что на последнем этапе b-окисления образуется одна молекула ацетил-SКоА и одна молекула пропионил-SКоА. Последний затем карбоксилируется и включается в дальнейшее окисление в форме сукцинил-SКоА (рисунок 4.15).
Расщепление ненасыщенных жирных кислот в ходе b-окисления происходит через дополнительные стадии гидратации по месту двойной связи между вторым и третим атомами углерода.
Обязательным условием в таком случае является наличие транс-двойной связи. В случае цис-изомера жирной кислоты необходим дополнительный фермент – цис-транс-изомераза. D-изомер, образующийся в ходе гидратации цис-связи, преобразуется ферментом эпимеразой в L-форму жирной кислоты. После таких преобразований цикл b-окисления продолжается как обычно (рисунок 4.16).
| катаболизм некоторых аминоксилот
(триптофан, изолейцин, метионин)
| |

| жирная кислота
(n-нечетное число)
| |
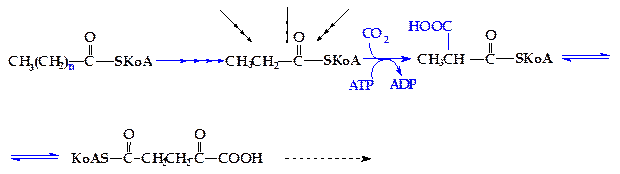
Рисунок 4.15 - b-Окисление жирных кислот с нечетным числом
атомов углерода в цепи (конечные стадии)
       Рисунок 4.16 - Дополнительные реакции b-окисления ненасыщенных жирных кислот
Рисунок 4.16 - Дополнительные реакции b-окисления ненасыщенных жирных кислот
|
Липиды, в особенности жирные кислоты, могут неферментативно, под влиянием различных веществ окисляться до пероксидов (особенно характерен этот процесс для ненасыщенных жирных кислот). Такой процесс называется перекисным окислением липидов.
На рисунке 4.17 изображены примеры образования перекисей липидами различной природы.
Чрезмерное свободнорадикальное окисление липидов приводит к прогорканию масел, а в организме – к поражению мембран клеток, инактивации ферментов, накоплению биологически инертных полимеров.
При избыточном количестве липидов в пище, заболевании диабетом
| участок молекулы жирной кислоты
| | 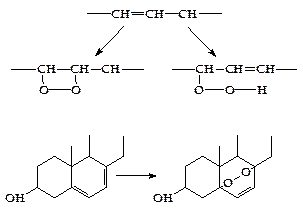
|
Рисунок 4.17 - Химизм перекисного окисления липидов
образуются кетоновые (или ацетоновые) тела, представляющие собой смесь ацетона, ацетоуксусной кислоты и b-гидроксибутирата.
В норме образуется небольшое количество кетоновых тел. В небольших количествах они выделяются почками или преобразуются в ацетил-SКоА (в сердце, мышцах, мозгу, но не в печени).
Избыточное накопление кетоновых тел вызывает кетонурию – повышенное содержание последних в моче.
АНАБОЛИЗМ ЛИПИДОВ
Долгое время считали, что биосинтез высших жирных кислот осуществляется путем обращения реакций b-окисления высших жирных кислот. Однако было обнаружено, что хотя исходным соединением для синтеза высших жирных кислот является ацетил-SКоА, механизм биосинтеза высших жирных кислот существенно отличается от простого обращения реакций b-окисления.
Полный синтез насыщенных жирных кислот осуществляется в растворимой части цитоплазмы. Процесс синтеза катализируется особым синтазным комплексом, называемым синтазой высших жирных кислот. Этот мультиферментный комплекс имеет молекулярную массу 400-560 кДа и состоит он из двух идентичных полипептидных цепей (димер). Каждая из цепей (мономеров) длиной около 2300 аминокислотных остатков образует в третичной структуре три домена и в их составе 7 субдоменов, одним из которых является ацилпереносящий белок (АПБ), а шести остальным присуща определенная ферментативная функция.
Ацилпереносящий белок служит «якорем», к SH-группе которого в ходе удлинения цепи жирной кислоты прикрепляются ацильные промежуточные продукты. Ацилирование субдомена АПБ осуществляется путем образования тиоэфирной связи.
Еще одной особенностью биосинтеза жирных кислот является его пространственная компартментализация. Если b-окисление жирных кислот протекает в митохондриях, то их биосинтез протекает в цитоплазме. Только жирные кислоты с длиной цепи более 16 атомов углерода синтезируются в митохондриях, здесь же протекает процесс превращения насыщенных кислот в ненасыщенные.
Ацетил-SКоА образуется в клетке преимущественно в процессе внутримитохондриального окисления. Известно, что митохондриальная мембрана не проницаема для ацетил-SКоА, а потому в клетке имеются его специальные переносчики, а если быть точнее целые транспортные системы: ацил-карнитиновая и цитрат-транспортная системы.
Процесс биосинтеза высших жирных кислот с участием синтазы высших жирных кислот включает ряд этапов.
Первым этапомв синтезе жирных кислот является образование малонил-SКоА из ацетил-SКоА и СО2 (АТФ-зависимое карбоксилирование):
СО2 + СН3-СO~SKoA + АТФ ¾¾® НООС-Н2С-СО~SKoA + АДФ + Фн
Вторым этапом в синтезе жирных кислот можно считать активацию ацетил-SКоА путем присоединения его к SН-группе АПБ. Подобным образом идет образование малонил-АПБ. Реакции катализируются ферментом траснацилазой.
Третьим этапом синтеза является собственно конденсация ацетил-АПБ и малонил-АПБ, в результате чего под действием конденсирующего фермента 3-кетоацилсинтетазы образуется 3-кетобутирил-АПБ (ацетоацетил-АПБ). Дальнейшие превращения наглядно представлены на рисунке 4.18.
Завершается первая стадия синтеза перемещением насыщенного ацильного радикала на свободную SH-группу цистеина, а новая молекула малонил-SКоА взаимодействие с HS-АПБ, цикл повторяется вновь еще шесть раз, и каждый новый остаток малоната, декарбоксилируясь, встраивается в углеродную цепь до тех пор, пока не образуется 16-углеродный пальмитоил-АПБ. Завершается синтез жирной кислоты гидролитическим отщеплением HS-АПБ под действием деацилазы, не входящей в состав синтазы жирной кислоты.
Суммарное уравнение реакции образования пальмитиновой кислоты при участии синтазы имеет следующий вид:
СН3СО-SКоА + 7 НООССН2СО-SКоА + 14НАДФН.Н+ ¾®
¾® СН3(СН2)14СООН + 7СО2 + 8HS-KoA + 14НАДФ+ + 6Н2О
Синтез наиболее распространенных моноеновых жирных кислот (пальмитолеиновой и олеиновой) протекает в клетках печени непосредственно из их предшественников – пальмитиновой и стеариновой кислот. В этом процессе молекулярный кислород выступает в роль акцептора водорода жирной кислоты и НАДФН.Н+. Реакция катализируется мультиферментным комплексом десатуразой.
Дата добавления: 2017-08-01; просмотров: 1404;



















































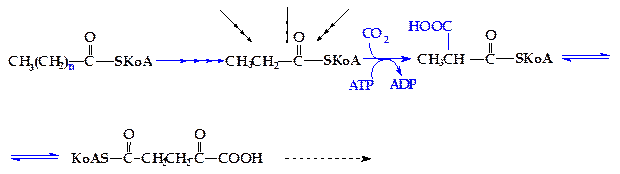






 Рисунок 4.16 - Дополнительные реакции b-окисления ненасыщенных жирных кислот
Рисунок 4.16 - Дополнительные реакции b-окисления ненасыщенных жирных кислот