Аминокислота аминокислота
Аналогичным способом образуются ди-, тетра-, пентапептиды и т.д. вплоть до крупной молекулы полипептида (белка).
Полипептидная теория строения не отрицает существования в молекуле белка и других связей, включая ковалентные (например, дисульфидные —S—S-связи) и нековалентные (например, водородные связи и др.).
Пептидные связи играют исключительную роль как в «архитектуре», так и в функции белков. Поэтому следует указать на некоторые особенности строения полипептидной цепи. Во-первых, это своеобразие расположения атомов углерода и азота, находящихся примерно в одной плоскости, и атомов водорода и радикалов, направленных к этой плоскости под углом 109°28'. Во-вторых, это своеобразие петидной связи: расстояние между атомами С и N в пептидной связи (равное 0,132 нм) является промежуточным между простой (ординарной) связью (связь —С—N—, равная 0,147 нм) и двойной связью (связь —C=N—, равная 0,125 нм). Это создает предпосылки для осуществления по месту двойной связи таутомерных перегруппировок и для образования енольной (лактимной) формы. Последняя в свою очередь дает молекуле белка ряд преимуществ (повышение реакционной способности, возникновение дополнительных возможностей вращения и др.):
|
|
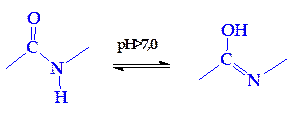
Взаимодействуя с окружающими молекулами растворителя (Н2О), функциональные группы (в частности, NH2- и СООН-группы) ионизируются, что приводит к образованию анионных и катионных центров белковой молекулы. В зависимости от соотношения ионов молекулы белка получают суммарный положительный (+) или отрицательный (–) заряд с определенным значением изоэлектрической точки (ИЭТ).
Изучение пространственной структуры белков показало наличие четырех уровней ее организации, условно названных: первичной, вторичной, третичной и четвертичной структурой.
Под первичной структурой белка подразумевают порядок или последовательность расположения аминокислотных остатков в полипептидной цепи. Если в состав белка входит несколько полипептидных цепей, объединенных в одну белковую молекулу посредством дисульфидных связей и нековалентных взаимодействий, или если одна полипептидная цепь содержит внутренние дисульфидные связи, то задача определения первичной структуры несколько осложняется, так как необходимо предварительное разъединение этих цепей и связей.
Расшифрованы первичные структуры миоглобина человека (153 аминокислотных остатка), α-цепи (141) и β-цепи (146) гемоглобина человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока человека (130), химотрипсиногена быка (245), рибонуклеазы (124) и многих других белков, в том числе ферментов и токсинов.
Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т.е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре белка. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: a-спирали и β-структуры.
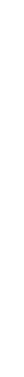 Наиболее вероятным типом строения глобулярных белков принято считать a-спираль (рисунок 2.1). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков.
Наиболее вероятным типом строения глобулярных белков принято считать a-спираль (рисунок 2.1). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков.
  Рисунок 2.1 - Структура и параметры
α-спирали
Рисунок 2.1 - Структура и параметры
α-спирали
|
Движущей силой в возникновении a-спиралей (так же как и β-структур) является способность аминокислот к образованию водородных связей.
В структуре a-спиралей открыт ряд закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26°, через 5 витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется. Это означает, что период повторяемости (или идентичности) a-спиральной структуры составляет 2,7 нм.
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β-структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между -NH- и -СО-группами соседних цепей, образуя структуру типа складчатого слоя (рисунок 2.2).
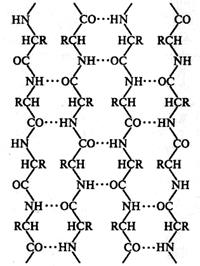 Рисунок 2.2 - Схематическое
изображение β-структуры
полипептидных цепей
Рисунок 2.2 - Схематическое
изображение β-структуры
полипептидных цепей
|
В природе существуют белки, строение которых, однако, не соответствует ни β-, ни a-структуре. Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
Методами рентгеноструктурного анализа в настоящее время доказано существование еще двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены.
Надвторичные структуры представляют собой агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках в результате их термодинамической или кинетической стабильности. Так, в глобулярных белках открыты (βхβ)-элементы (представлены двумя параллельными β-цепями, связанными сегментом х), βaβaβ-элементы (представлены двумя сегментами α-спирали, вставленными между тремя параллельными β-цепями) и др. (рисунок 2.3).
 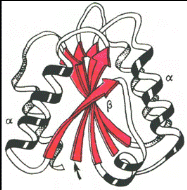 Рисунок 2.3 - Доменное строение глобулярного белка (флаводоксина) (по А. А. Болдыреву)
Рисунок 2.3 - Доменное строение глобулярного белка (флаводоксина) (по А. А. Болдыреву)
|
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
В настоящее время получены доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи. К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д. (рисунок 2.4).
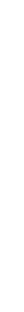  а - электростатическое взаимодействие; б - водородная связь; в - гидрофобные
взаимодействия неполярных групп; г - диполь-дипольные взаимодействия;
д - дисульфидная (ковалентная) связь
Рисунок 2.4 - Типы нековалентных связей, стабилизирующих
третичную структуру белка
а - электростатическое взаимодействие; б - водородная связь; в - гидрофобные
взаимодействия неполярных групп; г - диполь-дипольные взаимодействия;
д - дисульфидная (ковалентная) связь
Рисунок 2.4 - Типы нековалентных связей, стабилизирующих
третичную структуру белка
|
Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды, образуя гидрофильную поверхность.
В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы. Конформацией принято называть пространственное расположение атомов в молекуле белка. Этот термин означает структурное состояние молекулы белка, которое может переходить без разрыва ковалентных связей в другое структурное состояние, вызванное, например, вращением вокруг единственной связи.
В процессе укладки синтезированной полипептидной цепи, получившем название фолдинга – формирование нативной пространственной структуры, в клетках происходит отбор из множества стерически возможных состояний одной-единственной стабильной и биологически активной конформации, определяемой первичной структурой.
Высшим уровнем организации белков является четвертичная структура. Под четвертичной структурой белка подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Каждая отдельно взятая полипептидная цепь, получившая название протомера (мономера или субъединицы), чаще всего не обладает биологической активностью. Образовавшуюся молекулу принято называть олигомером (мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами.
Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности.
Классификация белков. В настоящее время еще не разработана стройная система номенклатуры и классификации белков.
В соответствии с функциональным принципом различают 12 главных классов белков: 1) каталитически активные белки (ферменты); 2) белки-гормоны (хотя есть и стероидные гормоны); 3) белки-регуляторы активности генома; 4) защитные белки (антитела, белки свертывающей и антисвертывающей систем крови); 5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) сократительные белки; 9) рецепторные белки; 10) белки-ингибиторы ферментов; 11) белки вирусной оболочки; 12) белки с иными функциями.
Были предприняты также попытки классифицировать белки, исходя из особенностей вторичной и третичной структуры. В соответствии с этим различают a-, β-, a+β- и a/β-белки. a-Белки содержат только α-спирали (не менее 60%), β-белки – только β-структуры (не менее двух антипараллельных цепей), a+β-белки – те и другие структуры в пределах одной полипептидной цепи (пример – молекулы лизоцима), а класс a/β-белков содержит множество a- и β-структур, чередующихся вдоль полипептидной цепи или домена (см. рисунок 2.3).
Согласно иной классификации, обширный класс белковых веществ разделяют в зависимости от их химического состава и делят на: простые и сложные белки.
Простые белкипостроены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты.
Сложные белки– это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины и др. Классификация сложных белков основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы), липопротеины (содержат липиды) и металлопротеины (содержат металлы).
Физико-химические свойства белков. Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот).
Заряд белков. Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований.
В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду.
Основной вклад в формирование кислотно-основных свойств вносят заряженные радикалы аминокислотных остатков, расположенные на поверхности глобулы. Основные свойства связаны с такими аминокислотами как лизин, аргинин, гистидин; кислые – аспарагиновой и глутаминовой кислотами.
Растворимость белков. Белки обладают ярко выраженными гидрофильными свойствами. Растворимость белков зависит от рН, а также от ионной силы раствора.
Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, а, в частности, явление светорассеяния (эффект Тендаля). Молекулы белка не способны проникать через полупроницаемые искусственные мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей. Вместе с тем белки не являются истинными коллоидами, так как они способны образовывать молекулярные растворы.
Молекулярная масса белков.Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 до 1000000 и выше.
Молекулярная масса сложных белков определяется кроме белковой части и составом небелкового компонента, а для олигомерных белков – молекулярной массой белковых субъединиц (протомеров) и их количеством в составе комплекса.
Форма белковых молекул.Белки по их форме разделяют на глобулярные (шарообразные) и фибриллярные (нитевидные). Форма молекул глобулярных белков динамична и под влиянием рН, температуры или ионной силы раствора может меняться. Глобулярные белки (например, гемоглобин, альбумины и глобулины) являются асимметричными в указанных измерениях.
Денатурация белков.Под денатурацией понимают нарушение пространственной структуры нативной молекулы белка (преимущественно третичной), приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.).
Внешние проявления денатурации сводятся к потере растворимости (особенно в изоэлектрической точке), повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи), в то время как пептидные связи остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Денатурирующие агенты делятся на химические и физические. Химические агенты – это органические растворители (ацетон, хлороформ, спирт), концентрированные кислоты, щелочи, ионы тяжелых металлов. В лабораторных условиях в качестве денатурирующих агентов используются мочевина или гуанидинхлорид, легко разрывающие водородные связи третичной структуры белка. К физическим факторам, вызывающим денатурацию относятся температурное воздействие (замораживание или нагревание), давление, ультразвук, облучение и др.
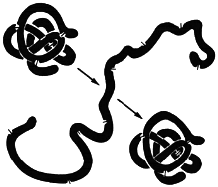
 При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рисунок 2.5), включая биологическую активность.
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рисунок 2.5), включая биологическую активность.  Такое явление получило название ренатурации.
Такое явление получило название ренатурации.
|
Рисунок 2.5 – Схематическое
Дата добавления: 2017-08-01; просмотров: 862;
