МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Любая каталитическая реакция предполагает изменение скоростей как прямой, так и обратной реакции за счет снижения ее энергетики. Если химическая реакция протекает с выделением энергии, то она должна начинаться спонтанно. Однако этого не происходит, потому что компоненты реакции должны быть переведены в активированное (переходное) состояние. Энергия, необходимая для перевода реагирующих молекул в активированное состояние, называется энергией активации. Переходное состояние характеризуется непрерывным образованием и разрывом химических связей, причем между переходным и основным состояниями существует термодинамическое равновесие. Скорость прямой реакции зависит от температуры и разности значений свободной энергии для субстрата в переходном и основном состояниях. Эта разность называется свободной энергией реакции.
 Ео, Ек — энергия активации реакции без и в присутствии катализатора; DG —
разность свободной энергии реакции
Рисунок 2.8 - Основное и переходное
состояния реагирующих веществ
Ео, Ек — энергия активации реакции без и в присутствии катализатора; DG —
разность свободной энергии реакции
Рисунок 2.8 - Основное и переходное
состояния реагирующих веществ
|
Достижение переходного состояния субстрата возможно двумя путями: за счет передачи реагирующим молекулам избыточной энергии (например, за счет увеличения температуры) или снижения энергии активации соответствующей химической реакции (рисунок 2.8).
Ферменты «помогают» субстратам принять переходное состояние за счет энергии связывания при образовании фермент-субстратного комплекса. Снижение энергии активации при ферментативном катализе обусловлено увеличением числа стадий химического процесса. Индуцирование ряда промежуточных реакций приводит к тому, что исходный активационный барьер дробится на несколько более низких барьеров, преодолеть которые реагирующие молекулы могут гораздо быстрее, чем основной.
Механизм ферментативной реакции можно представить следующим образом:
1) соединение фермента (Е) и субстрата (S) с образованием нестойкого фермент-субстратного комплекса (ES): Е + S ® E-S;
2) образование активированного переходного состояния: Е-S ® (ES)*;
3) высвобождение продуктов реакции (Р) и регенерация фермента (Е): (ES)* ® Р + Е.
Для объяснения высокой эффективности действия энзимов было предложено несколько теорий механизма ферментативного катализа. Наиболее ранней является теория Э. Фишера (теория «шаблона» или «жесткой матрицы»). Согласно этой теории фермент является жесткой структурой, активный центр которой представляет собой «слепок» субстрата. Если субстрат подойдет к активному центру фермента как «ключ к замку», то произойдет химическая реакция. Эта теория хорошо объясняет два типа субстратной специфичности ферментов — абсолютную и стереоспецифичность, но оказывается несостоятельной при объяснении групповой (относительной) специфичности ферментов.
Теория «дыбы» основана на представлениях Г. К. Эйлера, изучавшего действие гидролитических ферментов. По этой теории фермент связывается с молекулой субстрата в двух точках, при этом происходит растяжение химической связи, перераспределение электронной плотности и разрыв химической связи, сопровождающийся присоединением воды. Субстрат до присоединения к ферменту имеет «расслабленную» конфигурацию. После связывания с активным центром молекула субстрата подвергается растяжению и деформации (располагается в активном центре как на дыбе). Чем больше длина химических связей в субстрате, тем легче они разрываются и тем меньше энергия активации химической реакции.
В последнее время нашла широкое распространение теория «индуцированного соответствия» Д. Кошланда, которая допускает высокую конформационную лабильность молекулы фермента, гибкость и подвижность активного центра. Субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию, т. е. субстрат подходит к активному центру как «рука к перчатке».
Согласно теории индуцированного соответствия механизм взаимодействия фермента и субстрата следующий:
1. фермент по принципу комплементарности распознает и «ловит» молекулу субстрата. В этом процессе белковой молекуле помогает тепловое движение ее атомов;
2. аминокислотные остатки активного центра смещаются и подстраиваются по отношению к субстрату;
3. химические группировки ковалентно присоединяются в активном центре - ковалентный катализ.
Кинетика ферментативных реакций.Кинетика изучает скорости, механизмы реакций и влияние на них таких факторов, как концентрации ферментов и субстратов, температура, рН среды, присутствие ингибиторов или активаторов.
При постоянной концентрации субстрата скорость реакции прямо пропорциональна концентрации фермента (рисунок 2.9, а). График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид равнобочной гиперболы (рисунок 2.9, б).
Зависимость скорости ферментативной реакции от концентрации субстрата описывается уравнением Михаэлиса — Ментен:
 ,
,
где V — стационарная скорость биохимической реакции; Vmax — максимальная скорость; Кm — константа Михаэлиса; [S] — концентрация субстрата.
  а а
|   б б
|
Рисунок 2.9 - Зависимость скорости ферментативной реакции от
концентрации фермента (а) и субстрата (б)
Если концентрация субстрата низкая, т. е. [S] << Кm, то [S] в знаменателе можно пренебречь.
Тогда  .
.
Таким образом, при низких концентрациях субстрата скорость реакции прямо пропорциональна концентрации субстрата и описывается уравнением первого порядка. Это соответствует начальному прямолинейному участку кривой V = f[S] (рисунок 2.9, б).
При высоких концентрациях субстрата [S] >> Кm, когда Кm можно пренебречь, уравнение Михаэлиса — Ментен приобретает вид
 , т.е. V=Vmax.
, т.е. V=Vmax.
Таким образом, при высоких концентрациях субстрата скорость реакции становится максимальной и описывается уравнением нулевого порядка. Это соответствует участку кривой V =f [S], параллельному оси абсцисс.
При концентрациях субстрата, численно сравнимых с константой Михаэлиса, скорость реакции возрастает постепенно. Это вполне согласуется с представлениями о механизме ферментативной реакции:
k1 k3

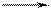
 S + Е ES Р + Е
S + Е ES Р + Е
k2
где S — субстрат; Е — фермент; ES — фермент-субстратный комплекс; Р — продукт; k1 — константа скорости образования фермент-субстратного комплекса; k2 — константа скорости распада фермент-субстратного комплекса с образованием исходных реагентов; k3 — константа скорости распада фермент-субстратного комплекса с образованием продукта.
Скорость превращения субстрата с образованием продукта (Р) пропорциональна концентрации фермент-субстратного комплекса [ES]. При малых концентрациях субстрата в растворе имеется некоторое число свободных молекул фермента (Е), не связанных в комплекс (ES). Поэтому при увеличении концентрации субстрата концентрация комплексов растет, следовательно, растет и скорость образования продукта. При больших концентрациях субстрата все молекулы фермента связаны в комплекс ES (явление насыщения фермента), поэтому дальнейшее повышение концентрации субстрата практически не увеличивает концентрацию комплексов и скорость образования продукта остается постоянной.
Таким образом, становится ясен физический смысл максимальной скорости ферментативной реакции. Vmах — это скорость, с которой реагирует фермент, полностью существующий в виде фермент-субстратного комплекса.
Константа Михаэлиса численно соответствует такой концентрации субстрата, при которой стационарная скорость равна половине максимальной (см. рисунок 2.9, б). Данная константа характеризует константу диссоциации фермент-субстратного комплекса:
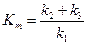 .
.
Физический смысл константы Михаэлиса в том, что она характеризует сродство фермента к субстрату. Кm имеет малые значения, когда k1 >(k2 + k3), т.е. процесс образования комплекса ES преобладает над процессами диссоциации ES. Следовательно, чем меньше значения Кm, тем сродство фермента к субстрату больше. И, наоборот, если Кm имеет большое значение, то (k2 + k3) > k1 и процессы диссоциации ES преобладают. В этом случае сродство фермента к субстрату небольшое.
Ингибиторы и активаторы ферментов. Ингибиторами ферментов называются вещества, снижающие активность ферментов. Любые денатурирующие агенты (например, соли тяжелых металлов, кислоты) являются неспецифическими ингибиторами ферментов.
Обратимые ингибиторы — это соединения, которые нековалентно взаимодействуют с ферментом. Необратимые ингибиторы — это соединения, специфически связывающие функциональные группы активного центра и образующие ковалентные связи с ферментом.
Обратимое ингибирование разделяют на конкурентное и неконкурентное. Конкурентное ингибирование предполагает структурное сходство ингибитора и субстрата. Ингибитор занимает место в активном центре фермента, и значительное количество молекул фермента оказывается блокировано. Конкурентное ингибирование можно снять, если повысить концентрацию субстрата. В этом случае субстрат вытесняет конкурентный ингибитор из активного центра.
Обратимое ингибирование может быть неконкурентным в отношении субстрата. В этом случае ингибитор не конкурирует за место присоединения к ферменту. Субстрат и ингибитор связываются с разными центрами, поэтому появляется возможность образования комплекса IE, а также и тройного комплекса IES, который может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.
По характеру своего действия ингибиторы подразделяются на специфические и неспецифические.
Специфические ингибиторы оказывают свое действие на фермент, присоединяясь ковалентной связью в активном центре фермента и выключая его из сферы действия.
Неспецифическое ингибирование предполагает воздействие на фермент денатурирующих агентов (солей тяжелых металлов, мочевины и др.). В этом случае в результате разрушения четвертичной и третичной структуры белка происходит потеря биологической активности фермента.
Активаторы ферментов — это вещества, увеличивающие скорость ферментативной реакции. Чаще всего в качестве активаторов выступают ионы металлов (Fe2+, Fe3+, Cu2+, Co2+, Mn2+, Mg2+ и т.д.). Различают металлы, находящиеся в составе металлоферментов, являющиеся кофакторами, и выступающие в качестве активаторов ферментов. Кофакторы могут прочно связываться с белковой частью фермента, что же касается активаторов, то они легко отделяются от апофермента. Такие металлы являются обязательными участниками каталитического акта, определяющими активность фермента. Активаторы усиливают каталитическое действие, но их отсутствие не препятствует протеканию ферментативной реакции. Как правило, металл-кофактор взаимодействует с отрицательно заряженными группировками субстрата. Металл с переменной валентностью принимает участие в обмене электронов между субстратом и ферментом. Кроме того, они принимают участие в образовании стабильной переходной конформации фермента, что способствует более быстрому образованию ES комплекса.
Регуляция активности ферментов. Одним из основных механизмов регуляции метаболизма служит регуляция активности ферментов. Одним из примеров является аллостерическая регуляция, регуляция посредством активаторов и ингибиторов. Часто бывает так, что конечный продукт метаболического пути является ингибитором регуляторного фермента. Такой тип ингибирования называется ретроингибированием, или ингибированием по принципу отрицательной обратной связи.
Многие ферменты вырабатываются в виде неактивных предшественников-проферментов, а затем в нужный момент активируются за счет частичного протеолиза. Частичный протеолиз — отщепление части молекулы, которое приводит к изменению третичной структуры белка и формированию активного центра фермента.
Некоторые ферменты-олигомеры могут изменять свою активность за счет ассоциации - диссоциации субъединиц, входящих в их состав.
Многие ферменты могут находиться в двух формах: в виде простого белка и в виде фосфопротеида. Переход из одной формы в другую сопровождается изменением каталитической активности.
Скорость ферментативной реакции зависит от количества фермента, которое в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляции скорости ферментативной реакции является более медленным процессом, чем регуляция активности фермента.
Дата добавления: 2017-08-01; просмотров: 3884;
