II. Растворы подразделяются также по степени взаимодействия растворителя и растворенного вещества.
| Растворы | ||
| идеальные | предельно разбавленные | реальные (неидеальные) |
Идеальными растворами называются такие растворы, у которых сила взаимодействия между одноименными и разноименными молекулами одинакова.
А – растворенное вещество, fA-A
В – растворитель, fВ-В
Раствор АВ fA-A= fВ-В= fA-В
В идеальных растворах энергия взаимодействия молекул разных компонентов одна и та же; все молекулы раствора (растворенных веществ и растворителя) обладают одинаковым силовым полем, а объемы молекул всех компонентов равны. В идеальном жидком растворе, в отличие от идеального газа, между молекулами существует взаимодействие. Одинаковая энергия взаимодействия всех молекул в растворе приводит к их равномерному распределению в объеме. Поэтому энтропия смешения компонентов идеального раствора ΔS равна энтропии смешения идеального газа ΔSи.г. .
Одинаковый объем всех молекул обуславливает неизменность объема системы при образовании идеального раствора. Тепловой эффект при этом образовании идеального раствора равен нулю. В связи с этим можно дать другое определение идеальных жидких растворов. Идеальными будут такие растворы, образование которых из компонентов, взятых в одинаковом агрегатном состоянии и в любых соотношениях, не сопровождается изменением объема и тепловым эффектом, а изменение энтропии равно изменению энтропии при смешении идеальных газов, т.е.
ΔV=0; ΔH=0; ΔS=ΔSи.г.
Объем и энтальпия идеальных растворов аддитивны и зависят от состава раствора.
Следует иметь в виду, что идеальными могут считаться растворы, когда выполняются все вышеперечисленные условия и, кроме того, должны быть равны парциальные давления компонентов, у них должны быть одинаковая температура и одно и то же агрегатное состояние.
Идеальные растворы потому и называются идеальными, что они не существуют в действительности. Однако имеется значительное число растворов, близких по свойствам к идеальным растворам. К ним относятся разбавленные растворы.
Энергия Гиббса i-гокомпонента идеального раствора численно равна химическому потенциалу и может быть представлена следующим образом:
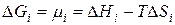
Когда ∆Hi =0, химический потенциал i-гокомпонента в идеальном растворе равен:
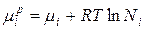 , где
, где
µi , µip – химические потенциалы i-го индивидуального компонента в растворе; Ni –мольная доля i-го компонента.
Продифференцируем данное уравнение и получим:
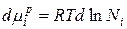
В связи с тем, что 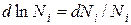 получаем:
получаем:
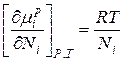
Это уравнение показывает соотношение между химическим потенциалом компонентов идеального раствора и его составом, определяемым мольной долей компонентов раствора.
Рассмотрим предельно разбавленные растворы, которые часто называют просто разбавленными. Предельно разбавленными растворами называются такие растворы, у которых растворитель подчиняется законом идеальных растворов, а растворимое вещество – законам реальных растворов.
Концентрация растворенного вещества в разбавленном растворе бесконечно мала, поэтому взаимодействием между его молекулами можно пренебречь. Тогда предельно разбавленные растворы можно описать закономерностями и уравнениями, которые справедливы для идеальных растворов.
Неидеальными (реальными) растворами называются такие растворы, у которых силы взаимодействия между одноименными и разноименными молекулами различны.
Раствор АВ fA-A ≠ fВ-В ≠ fA-В
Реальные растворы не подчиняются закономерностям идеальных и предельно разбавленных растворов. Однако, введя вспомогательные величины, свойства неидеальных растворов тоже можно выразить через закономерности идеальных растворов.
ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА НАД РАСТВОРОМ.
ЗАКОН РАУЛЯ.
Дата добавления: 2017-09-19; просмотров: 1982;
