V. Растворы. Способы выражения концентрации раствора. Закон Рауля.
Пример 1. Определить молярную (СМ), нормальную (СН), моляльную (Сμ) концентрацию и титр 5%-ного раствора CuSO4 (ρ = 1,005 г/см3), V = 1 л.
Решение: Масса 1 л 5%-ного раствора CuSO4 равна:
m р-ра = ρ . 1000 = 1,005 . 1000 = 1005 г
и содержит m (CuSO4) = 0,05 .1005 = 50,25 г растворенного вещества.
а) мольно-объемная концентрация, или молярность, показывает число молей растворенного вещества, содержащихся в 1 л раствора:
См = 50,25 = 50,25 = 0,314 М

 М(CuSO4) 160
М(CuSO4) 160
б) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора:
СН = 50,25 = 50,25 = 0,628 Н

 mэ (CuSO4) 80
mэ (CuSO4) 80
в) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя:
 Сμ = 50,25 . 1000 = 0,33 m
Сμ = 50,25 . 1000 = 0,33 m
160 (1005 – 50,25)
г) титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 50,25 г CuSO4 , то:
Т = 50,25 / 1000 = 0,05 г/см3 .
Пример 2. Смешали 15 мл 10%-ного раствора (ρ = 1,015 г/см3) азотной кислоты и 150 мл 30%-ного раствора (ρ= 1,15 г/см3) азотной кислоты. Чему равна процентная концентрация С% полученного раствора?
Решение:
а) Найдем массу 1-го раствора: m1 = ρ . V = 1,015 . 15=15,225 г, который содержит m (HNO3) = 10 / 100 . 15,225 = 1,52 г
б) Найдем массу 2-го раствора: m1 = ρ . V = 1,15 . 150 = 172,5 г, который содержит m (HNO3) = 30 / 100 . 172,5 = 51,75 г
в) Находим С% : 1,52 + 51,75
 С% = 15,22 + 172,5 • 100% = 28,38 %
С% = 15,22 + 172,5 • 100% = 28,38 %
Пример 3.Какой объем 0,3 н раствора хлорида натрия надо прибавить к 150 см3 0,16 н раствора нитрата серебра, чтобы осадить все находящееся в растворе серебро в виде хлорида серебра?
Решение.Вещества реагируют в эквивалентных количествах.
NaCl + AgNO3 = AgCl + NaNO3.
Следовательно, Сн(NaСl) ∙ Vp(NaСl) = Сн(AgNO3) ∙ Vp(AgNO3).
Откуда: Vp(NaСl) = Сн(AgNO3) ∙ Vp(AgNO3) / Сн(NaСl).
Подставляем значения: Vp(NaСl) = 0,16 ∙ 150 / 0,3 = 80 см3.
Пример 4.Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации 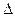 t = 0 - (-0,279) = 0,279°. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
t = 0 - (-0,279) = 0,279°. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
11,04 · 1000
 m = = 13,8 г
m = = 13,8 г
Подставляя в уравнение
m
 M = K
M = K
∆T
числовые значения, вычисляем молярную массу глицерина:
1,86 · 13,8
 М = = 92 г/моль
М = = 92 г/моль
0,279
Дата добавления: 2017-02-20; просмотров: 1317;
