Жирная кислота a-аминокислота
Все аминокислоты, входящие в состав природных белков, являются a-аминокислотами (так называемые протеиногенные аминокислоты), хотя аминогруппа в свободных аминокарбоновых кислотах может находиться и в β-, γ-, δ- и ε-положениях.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. «amphoteros» – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы.
Аминокислоты отличаются друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с a-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка.
Классификация аминокислот была разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают аминокислоты, содержащие следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (таблица 2.1) приведены наименования, сокращенные обозначения и структурные формулы аминокислот.
Таблица 2.1 – Классификация и структура a-аминокислот
| Алифатические аминокислоты (неполярные) | ||
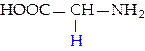 L-глицин (гли)
L-глицин (гли)
| 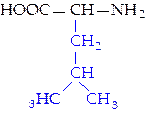 L-лейцин (лей)*
L-лейцин (лей)*
| |
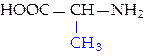 L-аланин (ала)
L-аланин (ала)
| ||
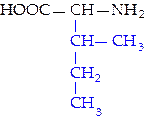 L-изолейцин (иле)*
L-изолейцин (иле)*
| ||
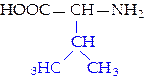 L-валин (вал)*
L-валин (вал)*
| ||
| Серосодержащие аминокислоты (полярные незаряженные) | ||
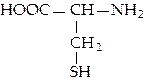 L-цистеин (цис)
L-цистеин (цис)
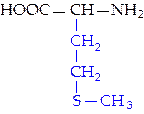 L-метионин (мет)*
L-метионин (мет)*
| 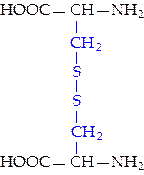 L-цистин (цин)
L-цистин (цин)
| |
| Гидроксиаминокислоты (полярные незаряженные) | ||
 L-серин (сер)
L-серин (сер)
| 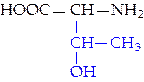 L-треонин (тре)*
L-треонин (тре)*
|
Продолжение таблицы 2.1.
| Дикарбоновые аминокислоты (отрицательно заряженные) | |
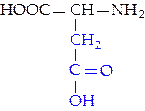 L-аспарагиновая кислота (асп)
L-аспарагиновая кислота (асп)
| 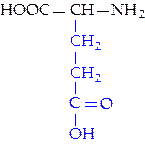 L-глутаминовая кислота (глу)
L-глутаминовая кислота (глу)
|
| Амиды дикарбоновых кислот (полярные незаряженные) | |
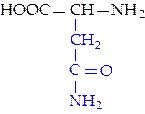 L-аспарагин (асн)
L-аспарагин (асн)
|  L-глутамин (глн)
L-глутамин (глн)
|
| Аминокислоты с катионообразующими группами в боковых цепях (положительно заряженные) | |
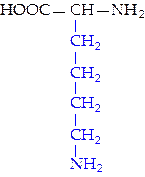 L-лизин (лиз)*
L-лизин (лиз)*
| 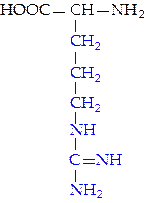 L-аргинин (арг)**
L-аргинин (арг)**
|
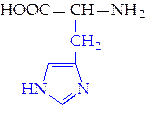 L-гистидин (гис)**
L-гистидин (гис)**
|
Окончание таблицы 2.1.
| Ароматические аминокислоты | |
 L-фенилаланин (фен)*
L-фенилаланин (фен)*
| 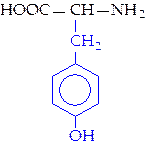 L-тирозин (тир)
L-тирозин (тир)
|
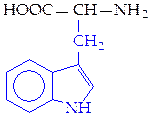 L-триптофан (три)*
L-триптофан (три)*
| Иминокислота
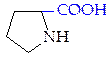 L-пролин (про)
L-пролин (про)
|
| * - отмечены незаменимые аминокислоты ** - отмечены частично незаменимые аминокислоты |
Для всех аминокислот, за исключением глицина, характерна оптическая активность. Они могут существовать в водных растворах в виде энантиомеров – D- и L-форм, в связи с наличием хирального атома углерода. Все a-аминокислоты существуют только в L-форме, однако в живой природе отмечано и наличие D-форм аминокислот, входящих в состав короткоцепочных пептидов.
Из 20 аминокислот, входящих в состав белков, только 10 способны синтезироваться в организме человека и млекопитающих. Такие аминокислоты получили название заменимых. Остальные 10 аминокислот являются незаменимыми, поскольку не могут синтезироваться в организме и должны поступать с пищей (таблица 2.1).
Аргинин и гистидин относятся к полунезаменимым, т.е. они могут синтезироваться в организме, но в количестве, недостаточном для сохранения нормальной жизнедеятельности.
В последние годы значительно повысился интерес к структуре и функциям встречающихся в свободном состоянии в организме низкомолекулярных пептидов. Короткие пептиды, содержащие до 10 аминокислот, принято называть олигопептидами.
Природные пептиды, наделенные биологической активностью, в зависимости от характера действия и происхождения принято делить на 4 группы: пептиды, обладающие гормональной активностью (вазопрессин, окситоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий гормон, рилизинг-факторы гипоталамуса и др.); пептиды, принимающие участие в процессе пищеварения (гастрин, секретин); пептиды, источник которых – a2-глобулиновая фракция сыворотки крови (ангиотензин, брадикинин, каллидин); нейропептиды.
Белки (полипептиды, протеины) – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название «протеины» (от греч. «protos» – первый, важнейший) более точно отражает первостепенное биологическое значение этого класса веществ.
Белки (протеины) составляют основу структуры и функции живых организмов. В природе встречается более 1010–1012 различных белков, обеспечивающих существование 106 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком.
Все природные белки состоят из небольшого числа сравнительно простых структурных блоков, представленных мономерными молекулами – a-аминокислотами, связанными друг с другом в полипептидные цепи.
Наиболее богаты белковыми веществами ткани и органы животных. Источником белка являются также микроорганизмы и растения. В мышцах, легких, селезенке, почках на долю белков приходится более 70–80% от сухой массы, а во всем теле животного – 45% от сухой массы.
Элементный состав белков в пересчете на сухое вещество представлен 50–54% углерода, 21–23% кислорода, 6,5–7,3% водорода, 15–17% азота и до 0,5% серы. В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества.
Благодаря своему многообразию белки выполняют множество самых разнообразных функций, характерных для живых организмов.
Каталитическая функция.К настоящему времени выделено в чистом виде и идентифицировано более 3500 ферментов. Большинство из известных в настоящее время ферментов является белками (исключением являются рибозимы – ферменты нуклеотидной природы). Эта функция белков, хотя и не оказалась уникальной, однако является определяющей скорость химических реакций в биологических системах.
Транспортная функция.Ряд белков выполняет функции переноса веществ от одного участка клетки к другому, или же от одного органа (клетки) к другому на уровне целого организма. Дыхательная функция крови, в частности перенос кислорода и углекислого газа, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов, гомонов, токсинов, лекарственных препаратов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени. Белки-каналы в клеточных мембранах обеспечивают транспорт и других ионов внутрь клетки.
Защитная функция.Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител (иммуноглобулинов (Ig)) с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена и тромбина, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий организм от потери крови при ранениях.
Сократительная функция.В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция тубулина, белка цитоскелета, обеспечивает расхождение хромосом и хроматид в процессах митоза и мейоза.
Структурная функция.Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека и животных. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная (регуляторная) функция.В организме существует класс белков, выполняющих регуляторные функции, – гормоны пептидно-белковой природы. Некоторые гормоны являются производными аминокислот (тироксин, трийодтиронин).
Питательная (резервная) функция.Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. К резервным белкам растений следует отнести проламины и глютелины.
Рецепторная функция.Рецепторные белки играют важную роль при передаче нервного или гормонального сигнала в клетку и ее отдельные компартменты. Рецепторы локализованы на мембранах, а механизмы передачи сигналов связаны с изменениями конформации белка, поглощением иил выделением энергии.
Строение белков.Впервые А.Я. Данилевский (1888), изучая биуретовую реакцию, высказал предположение о существовании во всех белковых веществах одинаковых групп атомов и связей, аналогичных биурету NH2—СО—NH—СО—NH2. Тем самым он первый указал на связь —NH—СО—(позднее получившую название пептидной связи) как на наиболее вероятный способ соединения аминокислот в белковой молекуле.
Образование пептидных связей, например, из трех разных аминокислот может быть представлено в виде следующей схемы:


|
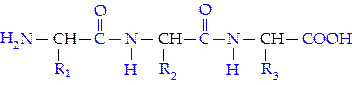 С-концевая
С-концевая
Дата добавления: 2017-08-01; просмотров: 904;
