Изображение процесса денатурации
И ренатурации белковой глобулы
Изоэлектрическая точка белков. При определенном значении рН раствора суммарный заряд белков, обладающих амфотерными свойствами, равен нулю. В таком состоянии белки не перемещаются в электрическом поле. Это значение рН носит название изоэлектрической точки (ИЭТ) и обозначается как pI. ИЭТ является характерной константой всех белков.
ИЭТ большинства белков животных тканей лежит в пределах значений рН от 5,5 до 7,0, что свидетельствует о частичном преобладании кислых аминокислот. Однако в природе имеются исключения – белки, у которых значения ИЭТ лежат в крайних значениях рН среды. В частности, величина ИЭТ пепсина (фермент желудочного сока) составляет 1,4, а сальмина (основной белок из молоки семги) – почти 12.
В изоэлектрической точке белки наименее устойчивы в растворе, имеют наиболее тонкую гидратную оболочку и легко выпадают в осадок. ИЭТ белка в сильной степени зависит от присутствия в растворе ионов солей; в то же время на ее величину не влияет концентрация белка.
Если в белковом растворе нет никаких ионов, кроме ионизированных аминокислотных остатков, то такие растворы называются изоионными. Изоионная точка как и ИЭТ является константой белков.
ФЕРМЕНТЫ
СТРОЕНИЕ И СВОЙСТВА ФЕРМЕНТОВ
Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций. Учение о ферментах выделено в самостоятельную науку – энзимологию.
От неорганических катализаторов ферменты отличаются рядом характерных особенностей. Прежде всего, ферменты чрезвычайно эффективны и проявляют в миллионы и миллиарды раз более высокую каталитическую активность в условиях умеренной температуры (температура тела), нормального давления и в области близких к нейтральным значениям рН среды.
Ферменты отличаются высокой специфичностью действия в отношении как химической природы субстрата, так и типа катализируемой реакции. Особенностью ферментов является также то, что их активность в клетках строго контролируется как на генетическом уровне, так и посредством определенных низкомолекулярных соединений, в частности субстратов и продуктов катализируемых реакций, ингибиторов, активаторов и др.
Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью; электрофоретической подвижностью, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
Подобно белкам, ферменты имеют большую молекулярную массу – от десятков тысяч до нескольких миллионов.
В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом. Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации.
Кофактор, который непосредственно не участвует в акте катализа, не является коэнзимом. В то же время простетическую группу можно назвать коферментом, если она непосредственно участвует в энзиматической реакции. Простетическая группа, которая не вовлечена в акт катализа, но функционально является существенным как для фермента, так и для некаталитического белка, может быть названа кофактором. Наконец, кофактор и кофермент, непрочно связанные (или слабо связанные) с ферментом или белком, тем не менее не классифицируются в качестве простетических групп.
Поскольку участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рисунок 2.6).
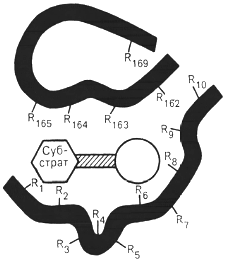 Темные полосы - участки полипептидной цепи фермента; R - аминокислотные остатки и их
порядковые номера (с N-конца)
Рисунок 2.6 - Схематическое
изображение активного центра
фермента (по Малеру и Кордесу)
Темные полосы - участки полипептидной цепи фермента; R - аминокислотные остатки и их
порядковые номера (с N-конца)
Рисунок 2.6 - Схематическое
изображение активного центра
фермента (по Малеру и Кордесу)
|
Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый протомер содержит один активный центр, связывающий субстрат, и один аллостерический центр, связывающий эффектор. Получены доказательства, что для субстрата аллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов – гетеротропными взаимодействиями.
В энзиматическом катализе, как и в реакции связывания субстрата, участвует не ограниченная и небольшая часть фермента, как предполагалось ранее, а значительно большая часть молекулы белка-фермента. Этими обстоятельствами, вероятнее всего, можно объяснить большие размеры и объемность трехмерной структуры молекулы фермента. Эти же обстоятельства следует учитывать в программах создания искусственных низкомолекулярных аналогов ферментов (синзимов), обладающих свойствами нативных ферментов.
Изоферменты (изоэнзимы) — это группы или семейства ферментов, которые катализируют одну и ту же реакцию, обладают одним и тем же типом субстратной специфичности, но отличаются друг от друга по аминокислотному составу, первичной структуре белка, молекулярной массе, а также по некоторым физико-химическим свойствам (электрофоретической подвижности, оптимуму рН, термостабильности, сродству к субстрату, чувствительности к ингибитору).
Изоферменты являются олигомерными белками, построенными из нескольких протомеров. Между собой изоферменты различаются на уровне четвертичной структуры. К энзимам, имеющим несколько молекулярных форм, относятся лактатдегидрогеназа (ЛДГ), креатинфосфокиназа (КФК), альдолаза, малатдегидрогеназа, холинэстераза и мн. др. Например, КФК является димером и имеет три изофермента: КФК1 (ВВ) — изофермент, характерный для мозга; КФК2 (MB) — для миокарда; КФК3 (ММ) — для скелетной мышцы.
Мультимолекулярные ферментные системы (мультиферменты) включают несколько ферментов, каждый из которых катализирует отдельную стадию многостадийного процесса в организме. Пространственное объединение нескольких последовательных реакций в мультиферментном комплексе имеет ряд преимуществ по сравнению с катализом отдельными ферментами: предотвращаются конкурентные реакции; последовательные реакции согласованы; промежуточные продукты не выделяются в цитоплазму; реакция протекает эффективно благодаря высокой концентрации субстрата при незначительных потерях за счет диффузии.
Примером мультиферментной системы является пируватдегидро-геназный комплекс, катализирующий превращение пирувата в ацетил-КоА. Он включает три фермента (пируватдегидрогеназу, дигидроли-поилацетилтрансферазу, дигидролипоилдегидрогеназу) и пять кофер-ментов (тиаминпирофосфат, амид липоевой кислоты, HS-KoA, ФАД+, НАД+).
Классификация ферментов.Современные классификация и номенклатура ферментов были разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в Москве. Комиссией были рассмотрены 3 принципа, которые могли служить основой для классификации ферментов и их обозначения.
Первый принцип – химическая природа фермента, т.е. принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемопротеинам, металлопротеинам и т. д. Однако этот принцип не мог служить общей основой для классификации, так как только лишь для небольшого числа ферментов известны простетические группы, доступные идентификации и прямому определению.
Второй принцип – химическая природа субстрата, на который действует фермент. По этому принципу трудно классифицировать фермент, так как в качестве субстрата могут служить разнообразные соединения внутри определенного класса веществ (белки, углеводы, липиды, нуклеиновые кислоты) и огромное количество промежуточных продуктов обмена.
В основу принятой классификации положен третий принцип – тип катализируемой реакции, который является специфичным для действия любого фермента.
Таким образом, тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) (таблица 2.2).
Оксидоредуктазы.К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы.
Таблица 2.2 – Основные классы ферментов и типы катализируемых ими реакций
| Класс ферментов | Тип катализируемой реакции |
| Оксидоредуктазы | Окислительно-восстановительные реакции всех типов |
| Трансферазы | Перенос отдельных атомов или групп атомов от донора к акцептору |
| Гидролазы | Гидролитическое ращепление химических связей |
| Лиазы | Негидролитичесое расщепление двойных связей или их образование |
| Изомеразы | Реакции взаимопревращения изомеров |
| Лигазы (синтетазы) | Соединение двух молекул и образование связей С—С, С—О, С—S и С—N, сопряженных с разрывом пирофосфатной связи АТФ |
Различают следующие основные оксидоредуктазы: аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
Трансферазы.К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др.
Например: метил- и формилтрансферазы, ацетилтрансферазы, аминотрансферазы, фосфотрансферазы и др.
Гидролазы.В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы.К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
Изомеразы.К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
Лигазы (синтетазы).К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества (например, L-глутамат: аммиак лигаза или глутаминсинтетаза, катализирующая синтез глутамина из глутаминовой кислоты и аммиака в присутствии АТФ).
Код каждого фермента содержит четыре цифры, разделенные точками, и составляется по определенному принципу. Первая цифра указывает номер одного из шести главных классов ферментов. Вторая цифра означает подкласс, характеризующий основные виды субстратов, участвующих в данном типе химических превращений. Например, у трансфераз вторая цифра указывает на природу той группы, которая подвергается переносу, у гидролаз – на тип гидролизуемой связи и т.д. Эти подклассы в свою очередь делятся на более частные подгруппы (подподклассы), отличающиеся природой химических соединений доноров или акцепторов, участвующих в данной подгруппе реакций. Номер (цифру) подподкласса ставят на 3-е место в шифре фермента. У гидролаз, например, эта цифра уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой группы и т.д. Первые 3 цифры кода точно определяют тип фермента. Наконец, все ферменты, относящиеся к данному подподклассу, получают порядковый номер в алфавитном порядке, который ставят на 4-е место в шифре.
Свойства ферментов.К ферментам применимы три основных критерия, характерных и для неорганических катализаторов. Во-первых, они остаются неизмененными после реакции, т.е. освобождаясь, могут вновь реагировать с новыми молекулами субстрата. Во-вторых, ферменты способны оказывать действие в очень малых концентрациях. И, наконец, наличие либо отсутствие фермента или любого другого катализатора не оказывает влияния на величину константы равновесия и свободной энергии (ΔG). Катализаторы лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая точки равновесия. Химические реакции с высокой константой равновесия и отрицательной величиной ΔG принято называть экзергоническими. Реакции с низкой константой равновесия и соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндергоническими. Для начала и завершения этих реакций необходим приток энергии извне.
Поскольку ферменты являются макромолекулами белковой природы, важное значение для их функций имеет первичная структура, определяющая тип катализируемых реакций. Для проявления каталитического действия большое значение имеет также нативность высших белковых структур. Обратимая денатурация является фактором подавления или восстановления ферментативной активности. Молекулярные массы ферментов лежат в пределах от 10 до 1000 кДa и более.
Специфичность действия. Способность того или иного фермента катализировать превращение определенного вещества (субстрата) зависит от природы как фермента, так и субстрата. Высокая стереоспецифичность ряда ферментов обусловлена комплементарным присоединением субстрата к ферменту в процессе каталитической реакции. Это особенно ярко проявляется в процессе реакций, характерных для L- или D-форм субстрата.
Кроме стереохимической, выделяют абсолютную и относительную специфичность действия ферментов.
Фермент, обладающий абсолютной субстратной специфичностью, имеет лишь один субстрат и катализирует его превращение (например, реакция образования мочевины при участии фермента аргиназы).
На скорость ферментативной реакции влияет не только природа атакуемой связи, но и ее окружение, а также длина углеродной цепи субстрата. Это особенно характерно для ферментов, проявляющих относительную, или групповую, специфичность.
Фермент, обладающий групповой специфичностью, может катализировать один и тот же тип реакции с разными субстратами. Ферменты класса гидролаз обладают групповой субстратной специфичностью. Так, например, протеазы осуществляют гидролиз пептидных связей в белках (пепсин, трипсин), липазы — гидролиз сложноэфирных связей в липидах (фосфолипазы), гликозидазы — гидролиз гликозидных связей в углеводах.
Термолабильность ферментов.Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10 °С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45–50 °С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50 °С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса (рисунок 2.7).
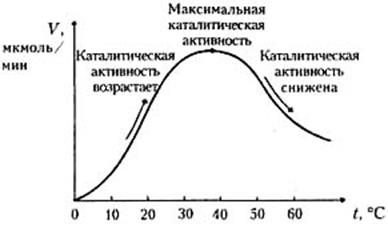
Рисунок 2.7 - Зависимость скорости ферментативной реакции
от температуры
При температуре 100 °С почти все ферменты утрачивают свою активность (исключение составляет миокиназа, которая выдерживает нагревание до 100 °С). При низких температурах (0 °С и ниже) ферменты, как правило, не разрушаются, однако активность их падает почти до нуля.
Зависимость активности ферментов от рН среды.Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей в основном выработанным в процессе эволюции физиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которой фермент проявляет максимальную активность. Эту точку называют оптимумом рН среды для действия данного фермента.
Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина, NH2-группы лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента, ионизации или деионизации активного центра, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса.
Дата добавления: 2017-08-01; просмотров: 1050;
