РІДИНИ ДЛЯ СИСТЕМИ ОХОЛОДЖЕННЯ ДВИГУНА
Як охолоджуючу рідину широко використовують воду.
Її переваги:
- висока теплоємність (4,19 кДж/кг);
- мала в’язкість;
- дешева сировина;
- безпечна для здоров’я;
- безпечна в пожежному відношенні.
Вода має порівняно низьку температуру кипіння, тому робоча температура її у відкритій системі охолодження не повинна перевищувати 90°С. При більш високих температурах вода інтенсивно випаровується. У розрідженій атмосфері температура кипіння води знижується, тому в гірських районах зі збільшенням висоти знижується припустима гранична температура води в радіаторі.
Вода має корозійні властивості за рахунок різних у ній газів, солей, СО2, О2. Вода також утворює накип і відкладення. Накип – це щільні, міцні відкладення, які утворюються на гарячихстінках системи охолодження. Наявність накипу збільшує використання мастила та палива.
Атмосферна вода найчистіша, бо в дощовій і сніговій водінемає розчиних солей і органічних речовин.
При використанні води як охолоджуючої рідини утворення відкладень у системі обумовлено наявністю мінеральних домішок, в основному розчинених у воді солей. Це дуже впливає на ефективність системи охолодження. Розчинені у воді солі утворюють у системі охолодження двигунів відкладення (накип), теплопровідність яких приблизно в 100 разів менше, ніж сталі. При відкладенні накипу порушується тепловий режим двигунів, збільшується витрата палива й масла.
Про кількість розчинених у воді солей судять по її твердості. Розрізняють тимчасову, постійну і загальну твердість води.
Тимчасова твердість води обумовлюється наявністю в ній бікарбонатів кальцію Са(НСО3)2 і магнію Мg(НСО)2, що термічно нестійкі і при нагріванні розкладаються. Процес протікає по рівнянню:
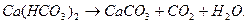
Карбонати кальцію і магнію, що утворюються, практично нерозчинні у воді, випадають в осад і утворюють накип на внутрішніх поверхнях деталей системи охолодження.
Постійна твердість зв'язана з наявністю солей СаSO4, МgSO4, МgSiO4, СаSiO3, СаCl2, МgСl2. Ці солі не випадають в осад при кипінні, якщо їхня концентрація не перевищує межі насичення. З них особливо велику шкоду приносять гіпс СаSO4, що дає винятково твердий накип, і МgСl2, що гідролізується при підвищених температурах з утворенням НС1. Загальна твердість води складається як сума тимчасової і постійної твердості.
За одиницю твердості приймають міліграм-еквівалент (мг-экв). 1 мг-екв відповідає такому вмісту солей, коли в 1л води утримується 20,04 мг іонів Са, або 12,16 мг іонів Мg.
Вода в залежності від складу розчинених у ній солей може бути м'якої, середньої твердості або твердої. М'яка вода містить до 3 мг-екв у 1 л, вода середньої твердості - від 3 до 6 і тверда - більш 6 мг-екв у 1 л.
Для зменшення утворення накипу в системі охолодження переважно застосовувати атмосферну (дощову, снігову) воду, що є м'якою.
Поверхневі і грунтові води рекомендується кип'ятити перед заливанням в систему або додавати до них антинакипіни, наприклад, хромпик (двуххромовокислий калій).
У більшості випадків тверду воду перед вживанням обробляють реагентами тринатріійфосфатом Nа3PO4, кальцинованою содою Nа2СO3 і ін. Ці реагенти ефективно взаємодіють із солями і переводять них у стани, що випадають у виді осаду. Тому реагенти можна застосовувати тільки для попередньої обробки води. Для прискорення реакції обробка повинна проводитися при нагріванні.
Для зм'якшення води застосовують також апарати, що представляють собою фільтр, заповнений природними мінералами (цеоліт, пермутит, глауконіт), що вступають в обмінну реакцію із солями твердості і заміняють у них іони кальцію і магнію на натрій.
Для зм'якшення води в умовах АТП можна рекомендувати такі методи, як застосування іонообмінних смол.
Застосування води в системі охолодження узимку ускладнює експлуатацію автомобільної техніки. Приходиться витрачати додаткову кількість палива для періодичного прогріву двигунів під час зупинок, зливати воду при збереженні на відкритих площадках і знову заливати її при пусках.
Дата добавления: 2016-05-11; просмотров: 1135;
