Термодинамика растворов
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения ее свойств.
Диффузия в растворах
Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе за счет теплового движения его молекул или атомов.
Закон Фика: количество вещества, диффундирующее за единицу времени через единицу площади поверхности пропорционально градиенту его концентрации:
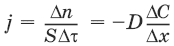
где j – диффузионный поток; D – коэффициент диффузии.
Уравнение Эйнштейна-Смолуховского:

где η – вязкость среды; R – радиус диффундирующих частиц.
Растворимость газов в газах
Закон Дальтона: общее давление газовой смеси равно сумме парциальных давлений всех входящих в нее газов:
Робщ = Σpi и pi = xi Робщ
Закон Генри-Дальтона: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью: Ci = kpi, где Ci – концентрация раствора газа в жидкости; k – коэффициент пропорциональности, зависящий от природы газа.
Как правило, при растворении газа в жидкости выделяется теплота (к < 0), поэтому с повышением температуры растворимость уменьшается.
Формула Сеченова:
X =Х0е-kСэл
где X и Х0 – растворимость газа в чистом растворителе и растворе электролита с концентрацией С.
Коллигативные свойства растворов неэлектролитов
Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц.
Дата добавления: 2016-04-23; просмотров: 832;
