Диаграмма состояния воды
К = 1. В системе возможны три фазовых равновесия: между жидкостью и газом (линия ОА), твердым телом и газом (линия ОВ), твердым телом и жидкостью (линия OC). Три кривые имеют точку пересечения О, называемую тройной точкой воды, – отвечают равновесию между тремя фазами и С = 0; три фазы могут находиться в равновесии лишь при строго определенных значениях температуры и давления (для воды тройная точка отвечает состоянию с Р = 6,1 кПа и Т = 273,16 К).
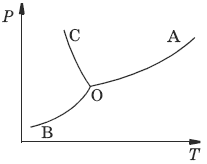
Внутри каждой из областей диаграммы (АОВ, ВOC, АOC) система однофазна; С = 2 (система бивариантна).
На каждой из линий число фаз в системе равно двум, и, согласно правилу фаз, система моновариантна: С = 1 – 2 + 2 = 1, т. е. для каждого значения температуры имеется только одно значение давления.
Влияние давления на температуру фазового перехода описывает уравнение Кла-узиуса – Клапейрона:
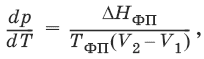
V 2, V1 – изменение молярного объема вещества при фазовом переходе.
Кривая равновесия «твердое вещество – жидкость» на диаграмме состояния воды наклонена влево, а на диаграммах состояния остальных веществ – вправо, т. к. плотность воды больше, чем плотность льда, т. е. плавление сопровождается уменьшением объема (AV < 0). В этом случае увеличение давления будет понижать температуру фазового перехода «твердое тело – жидкость» (вода – аномальное вещество). Для всех остальных веществ (т. н. нормальные вещества) ΔVпл > 0 и, согласно уравнению Клаузиуса-Клапейрона, увеличение давления приводит к повышению температуры плавления.
Свойства растворов
Дата добавления: 2016-04-23; просмотров: 1052;
