Условия самопроизвольного протекания процессов в закрытых системах
Изобарно-изотермические (Р = const, Т = const):
ΔG < 0, dG < 0
Изохорно-изотермические (V = const, Т = const):
ΔF < 0, dF < 0
Термодинамическим равновесием называется такое термодинамическое состояние системы с минимальной свободной энергией, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Условия термодинамического равновесия в закрытой системе
Изобарно-изотермические (Р = const, Т = const):
ΔG = 0, dG = 0, d 2G > 0
Изохорно-изотермические (V = const, Т = const):
ΔF = 0, dF = 0, d 2F > 0
Уравнения изотермы химической реакции:
Для реакции v1A1 + v2A2 + … = v′1B1 + v′2B2 + …
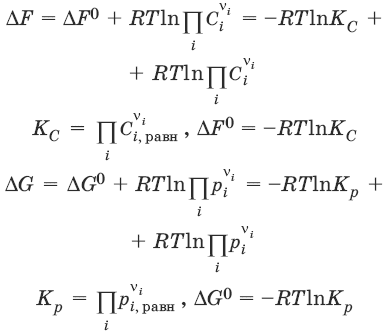
Здесь Ci,pi – концентрации, давления реагирующих веществ в любой момент времени, отличный от состояния равновесия.
Влияние внешних условий на химическое равновесие
Принцип смещения равновесия Ле Шателье-Брауна
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Влияние температуры на положение равновесия
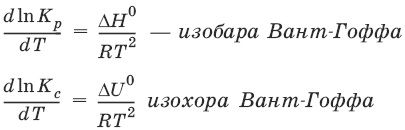
Экзотермические реакции: ΔН° < 0 (ΔU° < 0). Повышение температуры уменьшает величину константы равновесия, т. е. смещает равновесие влево.
Эндотермические реакции: ΔН° > 0 (ΔU° > 0). Повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Фазовые равновесия
Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне ее. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними.
Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
Правило фаз Дж. Гиббса:
Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие: С = К – Ф + n.
Для системы, на которую из внешних факторов влияют только температура и давление, можно записать: С = К – Ф + 2.
Принцип непрерывности – при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы.
Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния.
Дата добавления: 2016-04-23; просмотров: 2030;
