Растворы электролитов
Степень диссоциации α – отношение числа молекул n, распавшихся на ионы, к общему числу молекул N:
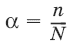
Изотонический коэффициент i Ван-Гоффа – отношение фактического числа частиц в растворе электролита к числу частиц этого раствора без учета диссоциации.
Если из N молекул продиссоциировало n, причем каждая молекула распалась на ν ионов, то
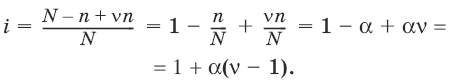
Для неэлектролитов i = 1.
Для электролитов 1 < i ≤ ν.
3.4. Коллигативные свойства растворов электролитов:

Теория электролитической диссоциации Аррениуса
1. Электролиты в растворах распадаются на ионы – диссоциируют.
2. Диссоциация является обратимым равновесным процессом.
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0,7), средней силы (0,3 < α < 0,7) и слабые (α ≤ 0,3).
Дата добавления: 2016-04-23; просмотров: 895;
