Виды растворов (знать).
Растворение – процесс обратимый: растворяемое вещество + растворитель ↔ вещество в растворе ± Q.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяются на разбавленные (содержат мало растворенного вещества) и концентрированные (содержат много растворенного вещества).
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор находится в равновесии с растворяемым веществом, называется насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества – ненасыщенным. В перенасыщенных растворах вещества содержится больше, чем в насыщенном. Растворимостью называется свойство вещества растворяться в воде и в других растворителях. Мерой растворимости или коэффициентом растворимости вещества при определенной температуре служит число граммов его, растворяющихся в 100 г воды.
По растворимости в воде твердые вещества условно делят на 3 группы:
1. Вещества, хорошо растворимые в воде (10 г вещества в 100, 0 воды. Например, в 1 л воды растворяется 200 г сахара).
2. Вещества, малорастворимые в воде (от 0, 01 до 10 г вещества в 100 г воды. Например: гипс CaSO4 в 1 л растворяется 2, 0).
3. Вещества, практически нерастворимые в воде (0, 01 г в 100, 0 воды. Например, AgCl – в 1 л воды растворяется 1, 5 * 10-3 г).
Растворимость вещества зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов).
Растворимость газов при повышении температуры уменбшается, при повышении давления увеличивается.
Зависимость растворимости твердых веществ от температуры показывает кривая растворимости.
Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить:
1. Коэффициент растворимости веществ при различных температурах.
2. Массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t10C до t20C.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
К сожалению, до настоящего времени не существует теории, позволяющей объединить результаты отдельных исследований и вывести общие законы растворимости. Подобное положение в значительной степени обусловлено тем, что растворимость различных веществ очень различно зависит от температуры.
Единственно, чем можно до некоторой степени руководствоваться – это старинным, найденным на опыте правилом: подобное растворяется в подобном. Смысл его в свете современных взглядов на строение молекул состоит в том, что если у самого растворителя молекулы неполярные или малополярные (например, бензол, эфир), то в нем будут хорошо растворяться от вещества с неполярными или малополярными молекулами, хуже – вещества с большей полярностью и практически не будут растворяться вещества, построенные по ионному типу. Наоборот, растворитель с сильно выраженным полярным характером молекул (например, вода) будет, как правило, хорошо растворять вещества с молекулами полярного и отчасти ионного типов и плохо – вещества с неполярными молекулами.
Выводы:
1.Растворение – процесс обратимый: растворяемое вещество + растворитель ↔ вещество в растворе ± Q.
2.По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
3.По относительным количествам растворенного вещества и растворителя растворы подразделяются на разбавленные (содержат мало растворенного вещества) и концентрированные (содержат много растворенного вещества).
4.Раствор, в котором данное вещество при данной температуре больше не растворяется называется насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества – ненасыщенным. В перенасыщенных растворах вещества содержится больше, чем в насыщенном.
5.Растворимостью называется свойство вещества растворяться в воде и в других растворителях.
6.Растворимость вещества зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов).
4. Способы выражения концентрации растворов: массовая доля
(знать).
Количественный состав раствора определяется его концентрацией.
Концентрация – это количество растворенного вещества, отнесенное к единице объема.
Различают два типа обозначений концентрации веществ – аналитические и технические.
Аналитические обозначения (молярная концентрация растворенного вещества, молярная концентрация эквивалента, молярность) – употребляются для растворов реагентов, применяемых в анализе веществ. здесь в качестве основной массовой единицы веществ используют моль.
Технические обозначения концентраций широко распространены в технике, медицине, фармации.
Объемный процент употребляют для обозначения концентрации смесей жидкостей или газов.
Массообъемный процент – количество вещества в граммах, содержащееся в 100 мл раствора.
Массовый процент (%) – количество граммов растворенного вещества, содержащееся в 100 г раствора.
Соотношение массы растворенного вещества к массе раствора называют массовой долей, ее выражают в долях единицы или процентах (устар. – процентная концентрация).
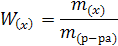
где: W(x) – массовая доля вещества х
m(x) – масса вещества х
m – масса всей системы (раствора)
Масса раствора представляет собой сумму масс растворенного вещества и растворителя: mр-ра = m(в-ва) + m(р-ля)
Например: если массовая доля уксусной кислоты равна 0, 03 (3 %), то это означает, что в растворе уксусной кислоты массой 100 г содержится CH3COOH массой 3 г и воды массой 100 – 3 = 97 г.
Если в условиях задачи указана плотность раствора, тогда предложенная формула выглядит так:
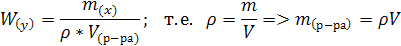
где: ρ – плотность раствора.
Дата добавления: 2016-10-17; просмотров: 3306;
