Молярная концентрация эквивалента (нормальная концентрация)
Молярная концентрация эквивалента C(1/Z Х) (или н-нормальность) – это число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора:
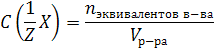
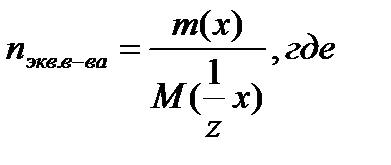
m(x) – масса растворенного вещества, г;
M(1/z x) – молярная масса эквивалента вещества, г/моль;
n экв. в-ва – количество вещества эквивалентов, моль.
Молярную концентрацию эквивалента вещества можно рассчитать по формуле:
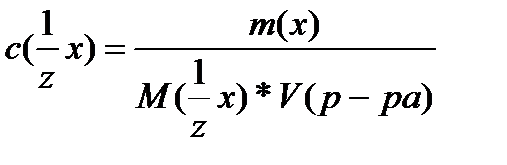
Раствор называется однонормальным или нормальным, если в 1 л его содержится 1 моль эквивалентов растворенного вещества.
При определении количества вещества, необходимого для приготовления раствора той или иной нормальности, необходимо знать правила определения эквивалентов.
Молярная массам эквивалента кислоты равна ее молярной массе, деленной на основнойсть кислоты.
Так для соляной кислоты масса эквивалента равна ее молярной массе. Для двухосновной серной кислоты масса эквивалента равна 49 г (98 : 2)
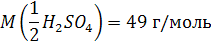
Молярная масса эквивалента основания равна его молярной массе, деленной на кислотность основания (валентность металла или число гидроксидных групп).
Например, молярная масса эквивалента гидроксида калия равна его молярной массе, а масса эквивалента гидроксида кальция Ca(OH)2 будет равна 74:2 = 37 г.
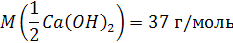
Для солей масса эквивалента равна молярной массе соли, деленной на произведение степени окисления металла и числа его атомов в молекуле соли.
Так масса эквивалента карбоната натрия равна 106 : (1 * 2) = 53 г.
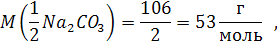
а масса эквивалента Al2(SO4)3 равна 342 : 6(3 * 2) = 57 г/моль
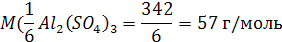
Дата добавления: 2016-10-17; просмотров: 11996;
