Раствор объемом 250 мл содержит гидроксид натрия массой 10 г. Определите молярную концентрацию эквивалента этого раствора.
| Дано: | Решение: |
| V (р-ра) = 250 мл = 0,25 л m (NaОН) = 10 г | 1. Находим молярную массу гидроксида натрия
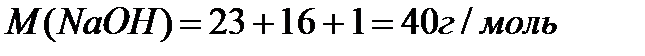 2. Находим молярную массу эквивалента гидроксида натрия:
2. Находим молярную массу эквивалента гидроксида натрия:
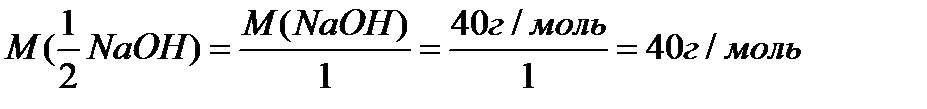 3. Молярная концентрация эквивалента раствора равна:
3. Молярная концентрация эквивалента раствора равна:
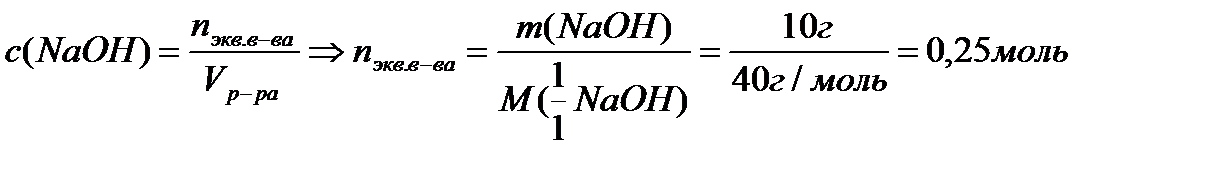
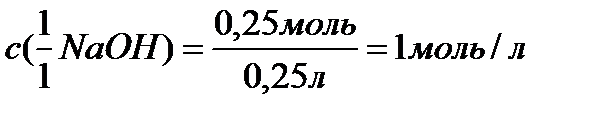
|
| Найти: с ( NaОН) | |
| Ответ: с (NaОН) = 1 моль/л |
2. Сколько граммов серной кислоты необходимо взять, чтобы приготовить 2 л раствора с молярной концентрацией эквивалента 0,1 моль/л?
| Дано: | Решение: |
| V (р-ра) = 2 л C (1/2 H2SO4) = 0,1 моль/л | 1. Вычислим число моль эквивалентов в растворе по формуле:
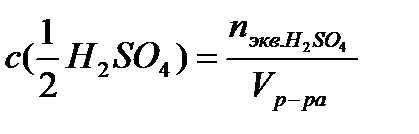 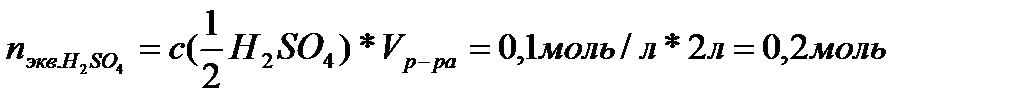 2. Масса серной кислоты. Необходимая для приготовления раствора:
2. Масса серной кислоты. Необходимая для приготовления раствора:
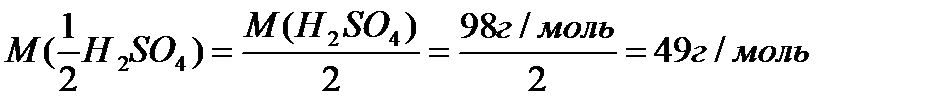
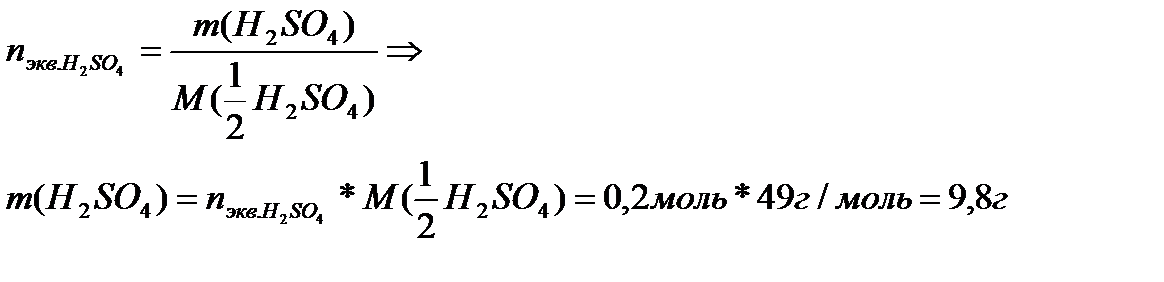
|
| Найти: m(H2SO4) | |
| Ответ: m (H2SO4) = 9,8 г Выводы: |
1.Концентрация – это количество растворенного вещества, отнесенное к единице объема.
2.Массовый процент (%) – количество граммов растворенного вещества, содержащееся в 100 г раствора.
Соотношение массы растворенного вещества к массе раствора называют массовой долей, ее выражают в долях единицы или процентах (устар. – процентная концентрация).
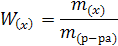
где: W(x) – массовая доля вещества х
m(x) – масса вещества х
m – масса всей системы (раствора)
3.Масса раствора представляет собой сумму масс растворенного вещества и растворителя: mр-ра = m(в-ва) + m(р-ля)
где: ρ – плотность раствора.
4.Молярная концентрация (молярность) – это число молей растворенного вещества, содержащееся в 1 л раствора:
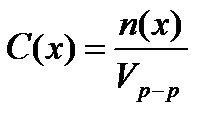
где: C (x) – молярная концентрация вещества Х
n (x) – количество растворенного вещества Х
V – объем раствора
Единица молярной концентрации моль/л.
Т. к.:
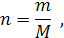
тогда:
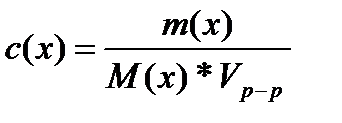
где: m(x) – масса растворенного вещества, г
V(р-р) – объем раствора, л
M(x) – молярная масса растворенного вещества, г/моль.
5.Молярная концентрация эквивалента C(1/Z Х) (или н-нормальность) – это число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора:
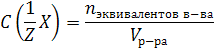
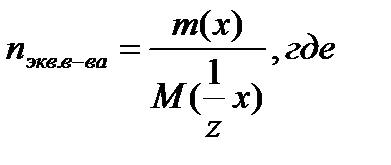
m(x) – масса растворенного вещества, г;
M(1/z x) – молярная масса эквивалента вещества, г/моль;
n экв. в-ва – количество вещества эквивалентов, моль.
Молярную концентрацию эквивалента вещества можно рассчитать по формуле:
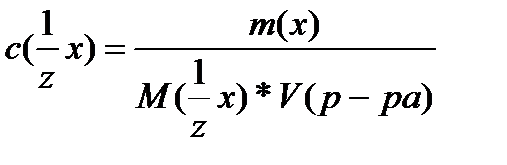
6.Молярная массам эквивалента кислоты равна ее молярной массе, деленной на основнойсть кислоты.
7.Молярная масса эквивалента основания равна его молярной массе, деленной на кислотность основания (валентность металла или число гидроксидных групп).
8.Для солей масса эквивалента равна молярной массе соли, деленной на произведение степени окисления металла и числа его атомов в молекуле соли.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Что такое растворы?
2. Как классифицируются растворы по агрегатному состоянию?
3. Из каких компонентов состоит раствор?
4. Какие растворы называются:
- насыщенными?
- ненасыщенными?
5. Что называется коэффициентом растворимости?
6. Какие растворы называются:
- разбавленными?
- концентрированными?
7. Как классифицируются все вещества по растворимости?
8. Как классифицируются все растворы в зависимости от размера дисперсной фазы?
9. Что называется массовой долей растворенного вещества?
10. В чем выражают массовую долю растворенного вещества?
11. Дайте определение молярной концентрации.
12. Назовите единицу измерения молярной концентрации.
13. Что называется молярной концентрацией эквивалента?
14. Как рассчитывается молярная масса эквивалента:
- кислоты?
- основания?
- соли?
15.Задачи для самостоятельного решения:
А)Сколько граммов иода и спирта надо взять для приготовления 500 г йодной настойки, представляющей собой 10 % раствор иода в спирте? (Ответ: 50 г иода и 450 г спирта)
Б)Сколько миллилитров 96% - ной серной кислоты (плотность 1,84 г мл) нужно взять для приготовления 1 л 0,5 н раствора? (Ответ: 13,84 мл)
Тестовые задания для самоконтроля:
В предложенных тестовых заданиях выберите все правильные ответы.
1. Какие из следующих веществ являются кристаллогидратами?
А K2SO3
Б CuSO4 * 5H2O
В RbOH
Г ZnSO4 * 7H2O
2. Какие из следующих веществ растворяются в воде?
А AlPO4
Б NaOH
В AgNO3
Г CuS
3. По какой формуле можно рассчитать массовую долю растворимого вещества?
А 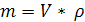
Б 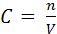
В 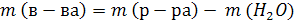
Г 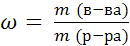
4. Сколько граммов растворенного вещества содержится в 50 г раствора с массовой долей W% (в-ва) = 10%?
А 10 г
Б 20 г
В 5 г
Г 40 г
5. Сколько молей растворенного вещества содержится в 1 л децимолярного раствора?
А 0,2 моль
Б 1 моль
В 0,1 моль
Г 0,01 моль
6. По какой формуле можно рассчитать молярную концентрацию раствора?
А 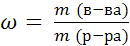
Б 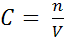
В 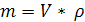
Г 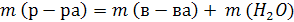
7. Эмульсия представляет собой:
А жидкий раствор
Б смесь нерастворимых друг в друге жидких веществ
В раствор яичного белка
Г средство для стирки
8. Коллоидный раствор отличается от истинного раствора:
А концентрацией
Б плотностью
В размерами частиц растворенного вещества
Г способами приготовления
9. Взвесь твердого вещества в жидкости называется:
А эмульсией
Б пеной
В суспензией
10. Растворителями могут быть вещества:
А только жидкие
Б только газообразные
В только твердые
Г все три перечисленные
11 Взвесями называют :
Дата добавления: 2016-10-17; просмотров: 8282;
