А. грубодисперсные системы
Б. тонкодисперсные системы
В. истинные растворы
12. Глюкоза в воде образует раствор:
А. молекулярный
Б. ионно- молекулярный
В. ионный
Г. верного ответа среди перечисленных нет
13. Золи относят :
А. к грубодисперсным системам
Б. к коллоидным растворам
В. к истинным растворам
Г. верного ответа среди перечисленных нет
14. Эмульсии представляют собой распределения мельчайших частиц:
А. жидкости в другой жидкости, не смешивающейся
С первой
Б. твердого вещества в жидкости
В. жидкости в газообразном веществе
Г. газообразного вещества в жидкости
15. Коагуляцией называют :
А. рассеяние светового луча частицами коллоидного раствора
Б. выделения воды за счет расслаивания геля
В. образование коллоидного раствора из грубодисперсной
Системы
Г. слипания частиц коллоидного раствора и выпадение
Их в осадок
16.Расположите двухкомпонентные системы в порядке уменьшения системы в порядке уменьшения размера частиц дисперсной фазы:
Коллоидный раствор
Взвесь
Истинный раствор
А. 1, 3, 2
Б. 2, 1, 3
В. 3, 2, 1
Г. 3, 1, 2
Ключевые понятия темы:
1.Если одно вещество мелко раздроблено и равномерно распределено в другом веществе, возникает дисперсная система.
2.Раздробленное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза – дисперсионной средой.
3.Суспензии(дисперсная фаза твердая, дисперсионная среда – жидкая) и эмульсии (жидкая и дисперсная фаза и дисперсионная среда).
4.Если в растворе размер дисперсной фазы равен 10-7 – 10-9 м, то такие растворы называются коллоидными.
5.Золи – это коллоидные системы, в которых дисперсионной средой является жидкость, а дисперсной фазой – твердое вещество.
6.Укрупнение коллоидных частиц – коагуляция, а выпадение их в осадок – седиментация.
7.Гели – особое студнеобразное коллоидное состояние. Дисперсная фаза и дисперсионная среда меняются ролями. Твердая фаза становится непрерывной, а частички жидкости – изолированными.
8.Растворы – гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов и продукты их взаимодействия.
9.Концентрация – это количество растворенного вещества, отнесенное к единице объема.
10.Массовый процент (%) – количество граммов растворенного вещества, содержащееся в 100 г раствора.
11.Соотношение массы растворенного вещества к массе раствора называют массовой долей, ее выражают в долях единицы или процентах (устар. – процентная концентрация).
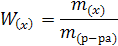
12.Молярная концентрация (молярность) – это число молей растворенного вещества, содержащееся в 1 л раствора:
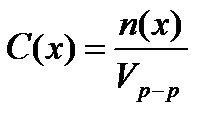
13.Молярная концентрация эквивалента C(1/Z Х) (или н-нормальность) – это число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора:
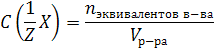
Домашнее задание:
ЛИТЕРАТУРА основная:
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-на-Дону. Феникс. 2005. Стр.128-148
2. Оганесян Э. Т., Книжник А. З. Неорганическая химия, М., Медицина, 2001 Стр. 129-142 (выборочно). Стр. 130-131, 135-136.
Литература дополнительная:
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 2009.
2. Глинка Н.Л. Общая химия. КноРус, 2009.
3. Егоров А.С. и др. Химия. Пособие репетитор для поступающих в ВУЗы. Ростов-на-Дону. Феникс,2003.
4. Кузьменко Н.Е., Еремин В.В. Начала химии. Современный курс для поступающих в вузы. М.: Экзамен, 2002.
5.Хомченко Г.П. Химия для поступающих в вуз. М.: Новая Волна, 2007.
6.Аликберова Л. Занимательная химия. М., «Арт – пресс», 2002 г.
7. Врублевский А. И. Химия. 6000 новых тестов для старшеклассников и абитуриентов. Минск. ЧУП «Издательство Юнипресс», 2007
8.Габриелян О. С, Остроумов И. Г. Химия. Пособие для школьников старших классов и поступающих в ВУЗы. М., Дрофа, 2005.
9.Тамаров М. А. Неорганическая химия. М.: Медицина, Феникс, 2001.
10. Пугачева О. А. Методические рекомендации по самоподготовке к практическим и семинарским занятиям. /учебное пособие: Калуга, 2008.
11.Пугачёва О.А. Теоретические основы неорганической химии.Растворы.Теория электролитической диссоциации./Учебно-методические пособие:Калуга, 2010.
Дата добавления: 2016-10-17; просмотров: 5286;
