КРИСТАЛЛИЗАЦИЯ ПРИ ХИМИЧЕСКОЙ РЕАКЦИИ В УСЛОВИЯХ ВСТРЕЧНОЙ ДИФФУЗИИ
В этом методе избыточная против равновесной концентрация вещества создается за счет химической реакции. Это возможно тогда, когда образующееся вещество имеет растворимость меньше, чем у исходных веществ. В качестве примеров приведем реакции:
CaCl2 + 2KF= ↓ CaF2 + 2KCl;
Pb (C2H302)2 + Zn = ↓ Pb + Zn (C2H302)2.
Движущая сила (§ 1.4) выражается приближенно в случае кристаллизации по химической реакции с образованием вещества AnYm следующим образом:
[А]n [Y]m = ПР.
Здесь А и Y — концентрации каждого из ионов
(рассматриваем наиболее распространенный случай — образование бинарного соединения); Пр — произведение растворимости; п и т — стехиометрические коэффициенты.
Обменные реакции с участием простых ионов идут с большой скоростью, лимитируемой практически только скоростью поступления исходных веществ в зону реакции. Поэтому при простом слиянии, а тем более перемешивании двух концентрированных растворов (пусть тех же СаС12 и KF), почти мгновенно проходящая реакция образования CaF2 приводит к образованию раствора этого вещества, по концентрации в сотни раз большей, чем концентрация насыщения. Вообще, малорастворимые соединения имеют очень большую ширину метастабильной зоны. Если же раствор достигает лабильной области, то происходит множественное зародышеобразование, приводящее к появлению мелкокристаллического, а то и коллоидного материала. Предотвратить это можно, либо существенно замедлив поступление исходных веществ в зону реакции, либо использовав растворы пониженной концентрации. Второй вариант более прост, поэтому начнем с него. Для целого ряда физических исследований достаточно иметь кристаллы с размерами, не превышающими десятые и сотые доли миллиметра. Для получения таких кристаллов [Мошкин С. В. и др., 1980] требуется всего лишь чашка Петри с крышкой и пара стеклянных полосок толщиной 1 —1,5 мм. Приготавливаются две порции исходных растворов объемом по 5 мл с такой концентрацией, чтобы при их слиянии, т. е. на объем 10 мл, создавалось пересыщение, соответствующее 300—500%, т. е. 3—5 концентрациям насыщения. Растворы сливаются в колбу, которая встряхивается 5—10 с, после чего раствор выливается в большую емкость чашки Петри (крышку) с положенными в нее заранее упомянутыми полосками стекла. Затем меньшая емкость, донной частью вниз, вводится внутрь большой и ставится на стеклянные полоски. Кристаллизация идет в растворе, находящемся в узкой щели между донными частями емкостей. Возникающие кристаллы способствуют быстрому снижению пересыщения и прекращению зародышеобразования. Отсутствие контакта раствора с воздухом также уменьшает вероятность возникновения зародышей сверх тех, которые возникли при смешении. Через несколько часов кристаллизация заканчивается, крышка вынимается, раствор осторожно сливается, а его остатки оттягиваются фильтровальной бумагой. Без извлечения кристаллов этот метод успешно используется для изучения под микроскопом особенностей кристаллизации, в частности, гипса.
Для получения более крупных кристаллов этот метод непригоден, и нужно переходить к обеспечению длительного и замедленного поступления реагентов к месту роста кристаллов. Как это сделать?
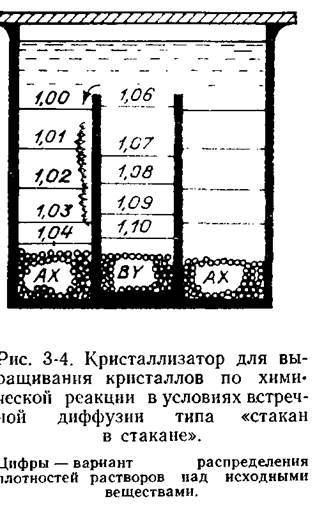
Ознакомимся с процессами, идущими в простейшем варианте кристаллизатора (рис. 3-4), который не дает возможности получить одиночные кристаллы, но зато позволяет понять ограничения этого метода. Возьмем два стакана с разными диаметрами и разной высоты,
|
поставим меньший внутрь большего, засыплем во внутренний и внешний стаканы исходные вещества АХ и BY соответственно (А и В —катионы, X и Y — анионы). Осторожно, по стеклянной палочке с грибообразным утолщением внизу, чтобы струя вливаемого растворителя не приводила к сильному перемешиванию и быстрому растворению вещества, зальем растворитель в каждый по отдельности стакан до краев внутреннего. Потом аккуратно добавим порцию растворителя, чтобы растворы соединились. Закроем стакан куском стекла, а щели замажем пластилином. Этого достаточно, чтобы потери воды были совершенно нечувствительны (заметим, что так сохранялись растворы без подпаривания в течение нескольких лет). Если все сделано правильно, в растворе не будет наблюдаться помутнения, обязанного появлению мельчайших кристаллов новообразования.
Первые изменения вне растворяющихся веществ заметны только через несколько часов или дней в зависимости от растворимости веществ и высоты внутреннего стакана над уровнем веществ.
Взаимодействие между компонентами в кристаллизаторе протекает следующим образом. Молекулярная диффузия приводит к возникновению градиентов концентрации по вертикали над подпиточным веществом. Градиент этот особенно велик при растворении хорошо растворимых соединений. Иначе говоря, при растворении и диффузии веществ вверх в сосудах возникает некоторое распределение концентраций, которому соответствует, например, указанное на рис. 3-4 распределение плотностей раствора. Когда, как показано на рисунке, у края внутреннего стакана окажутся растворы с различными плотностями, начнется перетекание более плотного раствора во внешний стакан (см. стрелку). Неидеально ровные края и нестрогая горизонтальность внутреннего стакана приводят к тому, что обычно переток через край происходит в одном месте (на рисунке — слева). В районе встречи исходных растворов концентрация раствора по труднорастворимому веществу AY быстро возрастает, она достигает концентрации насыщения, затем раствор становится пересыщенным. Когда же раствор перейдет в лабильное состояние, в нем начнутся самопроизвольное образование зародышей и их рост. В результате (в данном случае на внешней стенке стакана) сначала возникает в месте перетока
вертикальная полоска — корочка кристаллов AY. По достижении слоя жидкости с той же плотностью во внешнем стакане струйка растекается и смешивается со слоем раствора вещества АХ, что приводит к возникновению на стенках стаканов горизонтальных поликристаллических воротничков—друз кристаллов новообразования. Возникновение зародышей происходит и на удалении от стенок. Поэтому на поверхность исходного вещества, пока идет процесс, будет оседать микрокристаллический осадок вещества AY, приостанавливающий растворение исходной соли АХ. Витающие в растворе микрозародыши, оседая в различных положениях на кристаллы, закрепившиеся на стенках, дают начало новым кристаллам, и формируется более или менее равномерно зернистая корка.
События, развертывающиеся в описываемом кристаллизаторе, довольно типичны для всех случаев протекания химических реакций в подвижной, маловязкой среде, в которой образующиеся зародыши не закреплены. Успех борьбы с подвижностью зародышей и с образованием концентрационных потоков в значительной степени определяет успех в получении монокристаллов этим методом.
|
Обычным средством для достижения этого служит использование веществ, повышающих вязкость раствора в районе роста кристаллов. С помощью таких веществ одновременно регулируется скорость поступления исходных веществ в зону реакции. Для указанных целей давно используют желатин и агар-агар. Однако наилучшие результаты, по утверждению Г. Гениша [1973] и судя по частоте использования, дает гель на основе метасиликата натрия. Массовое соотношение метасиликата натрия и воды должно быть равно примерно 1 : 2. Этот раствор следует защищать от контакта с атмосферой, чтобы избежать поглощения им углекислого газа. Гели на основе желатина содержат 5—20% этого вещества, на основе агар-агара—1—5%. Гели пониженной плотности неэффективны, а с увеличением плотности геля качество кристаллов может ухудшаться. При хорошо подобранной плотности геля кристаллы растут во взвешенном состоянии, имея правильную форму. Заметим, что некоторые электролиты разжижают гели, приготовленные на основе органических веществ.
| J90 |
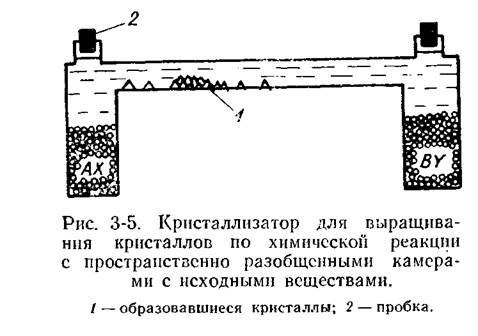
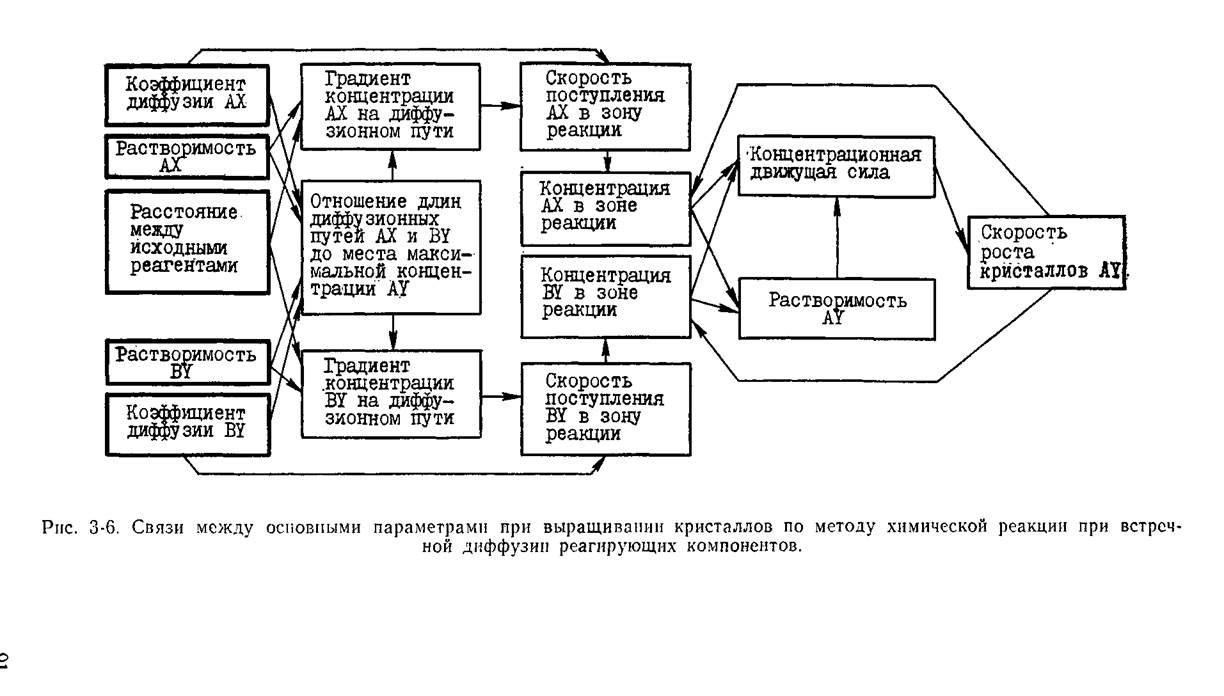
Перейдем к анализу процесса в типичном варианте кристаллизатора, схематически изображенном на рис. 3‑5. Сеть основных причинно-следственных связей изображена на рис. 3-6. Имея в виду удержать процесс в оптимальном интервале поступления вещества к кристаллам, т. е. вести его, не допуская слишком больших скоростей диффузии,
|
приводящих к массовому выпадению кристаллов, и слишком малых, неоправданно затягивающих процесс, выбирают длину кристаллизатора и исходные вещества с присущими им растворимостями и коэффициентами диффузии, зависящими от вязкости выбранной среды. Напомним (§ 1.6), что удельная скорость диффузии υ = V/S нормально к поверхности S определяется коэффициентом диффузии D и градиентом концентрации dc/dx:
υ = V/S=-D(dc/dx).
Удельная скорость диффузии через единицу поверхности V/S отождествлена с удельной (на единицу площади сечения) скоростью поступления вещества в зону реакции. Естественно, эта скорость определяется по отдельности для каждого компонента. Средний градиент концентрации на диффузионных путях — от местонахождения исходных веществ до возникающих кристаллов — в установившемся режиме диффузии есть
dc/dx ≈(c—c')/l,
где l — расстояние от данного исходного вещества (пусть АХ) до максимального скопления кристаллов; с — концентрация этого вещества в растворе вблизи поверхности АХ, соответствующая его насыщенному раствору; с' — концентрация АХ в зоне реакции. Ввиду малой растворимости кристаллизующегося вещества значение с' обычно ничтожно по сравнению с с. Поэтому можно принять, что dc/dx ≈c/l, а скорость поступления вещества в зону реакции V/S ≈D(d/l).
Если в этой формуле соответствующие величины выразить через мольные единицы, то в случае стехиометрических коэффициентов п=т=1можно приравнять скорости поступления разных веществ друг другу и определить отношение длин диффузионных путей АХ и BY до места их встречи, где выделяется максимальное количество кристаллического материала:
lAX/lBY = DAX Cax/(Dby CBy).
Из данной формулы следует, что образующиеся кристаллы будут располагаться ближе к тому из реагентов, коэффициент диффузии которого меньше (при близости их растворимостей), а при близости коэффициентов диффузии — ближе к тому реагенту, растворимость которого меньше. Поэтому, если в качестве исходных взять вещества с резко различающимися растворимостями, то новообразовавшееся вещество может давать кристаллы прямо на поверхности исходного, менее растворимого вещества. Так, при реакции между цинком и уксуснокислым свинцом кристаллы свинца растут на поверхности цинка. Мы упомянули соотношение растворимостей в качестве решающего фактора для оценки места встречи диффундирующих веществ потому, что различия между коэффициентами диффузии различных веществ, в общем, лежат в пределах одного порядка, тогда как растворимости могут различаться очень значительно.
Нарастание возникающих кристаллов на поверхности исходных веществ обычно нежелательно. Их часто нелегко отделить от исходного вещества, и, что более важно, возникшее химическое соединение препятствует доступу растворителя к поверхности исходного вещества, замедляя реакцию порой вплоть до ее прекращения.
По мере хода реакции в растворе накапливается второй продукт реакции (ВХ), обычно более хорошо растворимый. Если растворимость его велика, то он как-то изменяет растворимость AY и, кроме того, адсорбируясь, входит в нарастающих количествах, пусть небольших, в кристаллы AY. Это делает метод нестационарным. Однако он становится существенно более стационарным, если ВХ выделяется в виде самостоятельной твердой фазы. Очевидно, что это произойдет тем быстрее, чем меньше его растворимость. Так, если в раствор медного купороса поместить кристаллы кальцита, то на его поверхности очень скоро появляются и сферолиты малахита, и кристаллы гипса (кстати, эпитаксично нарастающие на кальцит).
Варианты технического оформления метода обычно просты, но многообразны. Многие из них описаны Г. Генишем [1973] и К.-Т. Вильке [1977]. Наиболее употребительны стандартные U-образные трубки, в которые на 3/4 высоты заливается гель, а после его застывания на его поверхность в разные колена трубки засыпаются и заливаются небольшим количеством воды исходные вещества. После герметизации трубка закрепляется в вертикальном положении, и постановка опыта завершена. Если затем кристаллов возникает много, это означает, что длина трубки мала или велики растворимости исходных веществ. Из анализа процесса должно быть ясно, что общее изменение диаметра трубки бесполезно. Однако сужение трубки в районе диффузионных путей одного или обоих веществ является средством регулирования скорости поступления вещества в зону реакции. Вещества особо труднорастворимые (PbS, BaSО4 и т. п.) удается выращивать при очень малых скоростях роста, и для уменьшения скоростей поступления веществ в реакционную зону требуются трубки большой длины, измеряемой десятками сантиметров.
Если кристаллы не появились через одну - две недели, то, видимо, малы растворимости исходных веществ или слишком длинен диффузионный путь. В такую трубку следует залить гель, скажем, до половины ее высоты.
Можно воспользоваться и прямыми трубками. В этом случае гель заливают в вертикальную трубку, нижний конец которой упирается в резиновый лист или закрыт резиновым колпачком. После застывания геля часть его извлекается из противоположных концов и в освободившиеся камеры помещаются исходные реактивы и растворитель. Герметизацию лучше проводить не с помощью пробок, которые довольно часто выдавливаются при изменении температуры в комнате, а с помощью тех же резиновых колпачков. Заметим, что в качестве гелеобразователя можно использовать и промытую глину. Очевидный ее недостаток — непрозрачность, достоинство — доступность и довольно высокая химическая инертность.
Есть опасность также захвата глины кристаллом. Однако ее недостатки становятся несущественными, если глиняные пробки нужны лишь на диффузионных путях для эффективного уменьшения скорости диффузии.
Помимо упомянутых способов управления процессом, можно еще указать на возможность подогрева одного из концов трубки, где требуется повысить растворимость. Это невозможно для обычных гелей из-за потери ими прочности при повышении температуры, но вполне возможно для кристаллизаторов с глиной.
Не должно быть неожиданным, что формы, размеры и качество кристаллов, выделяющихся вдоль трубки, оказываются разными. Вдоль трубки различны содержания вещества, и их влияние может сказываться очень резко, как это, например, было обнаружено при изучении роста кристаллов SrSО4 в кристаллизаторе, диффузионный канал которого представлял собой щель сечением 1X20 мм. Такой кристаллизатор можно помещать на столик микроскопа и следить за происходящими в нем изменениями по длине кристаллизатора и во времени, что важно для моделирования генезиса минералов.
Размер кристаллов, получаемых этим методом, составляет от долей до 10 мм, а с использованием пересадки кристаллов из одного кристаллизатора в другой — и больше. Однако последняя операция сопряжена с нарушением нормального хода процесса роста. Из необычных способов управления процессом следует упомянуть способ Я. Кашпара и др. [1965 г.], которые регулировали скорость диффузии компонентов с помощью разности электрических потенциалов.
Довольно большой перечень веществ, в том числе и аналогов многих минералов (кальцит, целестин, гипс, флюорит, цеолиты и многие другие), которые можно выращивать этим методом, обусловливает возрастающий интерес к нему, что позволяет надеяться на разработку методик получения кристаллов и более крупных, чем обычно получают этим методом. Здесь большое поле для инициативы в создании новых вариантов кристаллизаторов и методик.
Кристаллизация при химической реакции широко распространена в природе, и в частности при метасоматозе (реакции замещения), в результате чего новообразующийся минерал развивается по исходному минералу (замещает его). Реакция разыгрывается в тонкой пленке раствора на контакте между старым и новым минералом.
Дата добавления: 2016-09-20; просмотров: 1924;
