Химические эквиваленты
Эквивалентом элементов называется количество, соединяющееся с 8 массовыми частями кислорода или 1,0078 массовой частью водорода или замещающее те же количества кислорода или водорода в их соединениях.
Эквивалент элемента (простого вещества) рассчитывают по формуле:
Э = А/В, где Э – эквивалент элемента, г/моль; А – относительная атомная масса элемента, В – валентность элемента. Так эквивалент серы при получении SO2: S + O = SO2 равен ЭS = 32 : 4 = 8.
Эквивалентом сложного вещества называется такое его массовое количество, которое взаимодействует без остатка с одним эквивалентом водорода или кислорода или вообще с одним эквивалентом любого вещества.
Эквивалент сложного вещества определяют по формуле Э = М/В×n, где М – относительная молекулярная масса вещества; В – валентность (заряд) функциональных групп; n – число функциональных групп. Функциональные группы: для кислоты – ионы Н+; для основания – ионы ОН–; для соли – ионы Ме+.
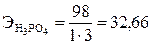 г/моль;
г/моль; 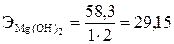 ;
; 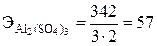 .
.
Эквивалент сложного вещества, так же как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество.
Эквивалент H2SO4 в реакции H2SO4 + KOH = KHSO4 + H2O равен 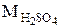 , а в реакции H2SO4 + Mg = MgSO4 + H2 равен
, а в реакции H2SO4 + Mg = MgSO4 + H2 равен 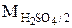 . Эквивалент Al(OH)3 в реакции Al(OH)3 + HCl = Al(OH)2Cl + H2O равен
. Эквивалент Al(OH)3 в реакции Al(OH)3 + HCl = Al(OH)2Cl + H2O равен 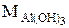 , а в реакции (Al(OH)3 + 3 HNO3 = = Al(NO3)3 + 3 H2O равен
, а в реакции (Al(OH)3 + 3 HNO3 = = Al(NO3)3 + 3 H2O равен 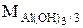 .
.
Дата добавления: 2016-08-07; просмотров: 1050;
