Взаимозависимые параметры состояния газов
Если энергия притяжения между молекулами меньше их кинетической энергии, то совокупность таких молекул будет существовать в виде газа. Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р – давлением; Т или t – температурой, измеряемой в Кельвина или градусах Цельсия; J - объемом, m – массой всего газа; М – грамм-молекулярной массой. Газовые законы устанавливают взаимосвязь между этими величинами.
Вначале были установлены законы, справедливые для постоянной массы данного газа (т.е. m = const и М = const), и, кроме того, одна из оставшихся величин (Р, J, Т) также поддерживается постоянной.
1. Т = const (изотермический процесс).
Взаимосвязь между изменением Р и J выражается законом Бойля-Мариотта:
Р1J1 = Р2J2 или РJ = const.
2. Р = const (изобарический процесс).
Взаимосвязь между изменением J и t выражается законом Гей-Люссака:
Jt = Jo (1 + at), где a – коэффициент удельного объемного расширения, равный для всех газов a = 1/273 град-1. Если это значение подставить в уравнение и температуру выразить в шкале Кельвина, то закон Гей-Люссака запишется так:
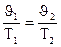 или
или 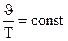 .
.
3. J = const (изохорический процесс).
Взаимосвязь между Р и t выражается законом Шарля: Рt = Po (1 + at) где
a = 1/273 град-1.
В более удобной форме можно записать так:
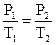 или
или 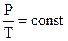 .
.
На основе трех частных законов можно вывести объединенный газовый закон:
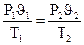 или
или 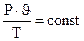 .
.
После того как было установлено экспериментально, что грамм-молекула любого газа при нормальных условиях (Р = 1 атм = 1,013×105 н/м2 = 101325 Па; t = 0 оС или Т = 273 К) занимает объем – 22,4 л (кг – молекула – 22,4×10-3 м3), объединенный газовый закон можно записать так: PJ = RT, где R - универсальная газовая постоянная.
Численное значение R зависит от единиц измерения величин, ее определяющих:
R = 62360 мм.рт.ст./К×моль = 0,082 л×атм/К×моль = 8,314 Па×м3/К×моль = = 8,314 Дж/К×моль = 8,414×103 кДж/К×моль = 1,987 кал/к×моль.
Уравнение PJ = nRT, где n = m/M, называется уравнением Менделеева-Клапейрона, оно выражает взаимосвязь между всеми величинами, характеризующими газ, а поэтому является наиболее общим в приближении к модели идеального газа.
Дата добавления: 2016-08-07; просмотров: 1329;
