Примеры составления условий задач и их решения. Вычислить тепловой эффект реакции при 298 К: 1) при Р = const;
Задача 240
Вычислить тепловой эффект реакции при 298 К: 1) при Р = const;
2) при J = const
2 Mg (к) + CO2 (г) = 2 MgO (к) + С (графит).
Тепловой эффект образования веществ при стандартных условиях найти по данным табл. 3 приложения.
Решение:
Находим стандартные энтальпии образования СО2 и MgO, которые равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Тепловой эффект данной химической реакции рассчитываем по формуле:
DНо298 = 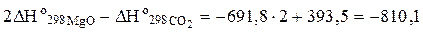 кДж/моль.
кДж/моль.
По известному значению теплового эффекта реакции DН при постоянном давлении можно рассчитать тепловой эффект реакции DU при постоянном объеме: DUо298 = DHo298 - DnRT, где Dn – изменение числа молей газообразных продуктов реакции и исходных веществ (Dn = Sn прод. - Sn исх.вещ.).
Dn = -1. Значение R = 8,314 Дж/моль К. Т = 298 К.
DUо298 = -810,1 – (-1) 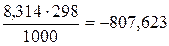 кДж/моль.
кДж/моль.
Задача 244
Определить стандартную энтальпию образования (DНо298 обр.) РН3, исходя из уравнения
2 РН3 (г) + 4 O2 (г) ® Р2О5 (к) + 3 Н2О (ж) : DНо = -2360,4 кДж.
Решение:
Согласно закону Гесса DНох.р.= 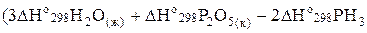 ).
).
Отсюда 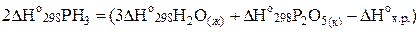 .
.
В таблице приложения находим стандартные энтальпии образования Н2О (ж) и Р2О5 (к):
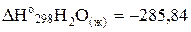 кДж/моль;
кДж/моль; 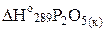 = –1492,0 кДж/моль, учитывая, что
= –1492,0 кДж/моль, учитывая, что 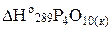 = –2984,0 кДж/моль.
= –2984,0 кДж/моль.
Находим 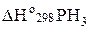 :
:
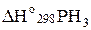 =
= 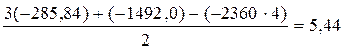 кДж/моль.
кДж/моль.
Задача 264
Вычислить, сколько моль СН3ОН (н.у.) нужно сжечь, чтобы выделилось 2500 кДж тепла, исходя из уравнения:
СН2ОН (ж) + 3/2 О2 (г) ® СО2 (г) + 2 Н2О (ж).
Решение:
Решение данной задачи осуществляется по плану решения предыдущей задачи:
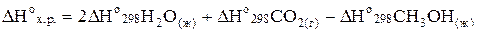 .
.
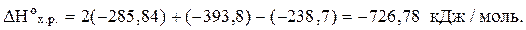
СН3ОН (ж) + 3/2 О2 (г) ® СО2 (г) + 2 Н2О (ж) + 726,78 кДж.
При сжигании 1 моль СН3ОН выделяется 726,78 кДж тепла, а при сжигании Х моль СН3ОН выделится 2500 кДж тепла:
Х = 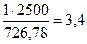 моль.
моль.
Для получения 2 500 кДж тепла необходимо сжечь 3,4 моль метилового спирта.
Задача 268
Используя термодинамические величины веществ, вычислить для реакции
Mg3N2 (к) + 6 H2O (ж) « 3 Mg(OH)2 (к) + 2 NH3 (г)
изменение энтальпии, энтропии и энергии Гиббса. Определить, в каком направлении возможно протекание реакции?
Решение:
Для расчета DGo298 воспользуемся уравнением
DGох.р. = DНох.р. – Т DSох.р. .
Находим DНо реакции:
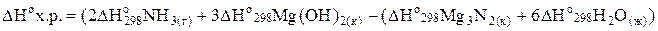 ;
;
DНох.р.=[2 (-46,19) + 3 (-924,66)] – [461,1 + 6(-285,840] = -690,22 кДж/моль.
Аналогично вычисляем:
DSox.p. =( 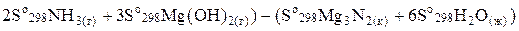 ;
;
DSox.p =(2×192,5 + 3,63,14) – (87,9 + 6×69,96) = 66,76 Дж/моль∙К.
Теперь находим DGo химической реакции, используя в качестве единой энергетической единицы килоджоуль:
DGox.p. = DHox.p. – T DSox.p.= 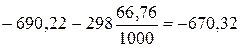 кДж/моль.
кДж/моль.
Таким образом, DGox.p. < 0, так что данная реакция термодинамически возможна (протекает слева направо).
Задача 280
Рассчитать приблизительно температуру, при которой устанавливается равновесие в системе
SiCl4 (г) + 2 H2 (г) « Si (к) + 4 HCl (г).
Решение: Находим DНo реакции:
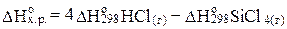 ;
;
DНox.p.= 4 (-92,4) – (-664,8) = 295,2 кДж/моль.
Аналогично вычисляем DSo реакции:
DSox.p.= (4So298HCl (г) + So298Si(к)) – ( 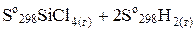 )
)
DSox.p.= (4×186,9 + 18,72) – (252,6 + 2×130,6) = 252,92 Дж/моль∙К.
В момент равновесия DGox.p.= 0, тогда DНox.p.= Т DSox.p.
Откуда Т = 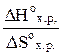 = 1166,79 К.
= 1166,79 К.
В задачах (205–214) составить термохимическое уравнение. Термодинамические данные взять из табл. 3 прилож.
205. При соединении 4,2г железа с серой выделилась теплота, соответствующая
7,15 кДж.
206. При сжигании 6,5 г цинка выделилась теплота, соответствующая 34,8 кДж.
207. При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты.
208. Путем сжигания серы получено 32 г оксида серы (IV) и выделилась теплота,
соответствующая 146,4 кДж.
209. При сжигании 6,08 магния выделилась теплота, соответствующая 152,5 кДж.
210. При разложении 1 кг известняка затрачивается 1 568,6 кДж.
211. При сгорании 31 г фосфора выделилась теплота, соответствующая
753,14 кДж.
212. При растворении 200 г оксида меди в соляной кислоте выделилась теплота,
соответствующая 159,15 кДж.
213. При разложении 500 г гидроксида кальция затрачивается 742,04 кДж.
214. При сгорании 50 г окcида серы (IV) выделилась теплота, соответствующая
76,72 кДж.
В задачах (215–240) вычислить тепловой эффект реакции при 298 К:
1) при Р = const ; 2) при V = const. Тепловой эффект образования веществ при стандартных условиях найти в табл. 3 прил.
| № | Реакции | № | Реакции |
| 215. | 2 H2 + CO « CH3OH (ж) | 228. | SO2 + Cl2 « SO2Cl2 (г) |
| 216. | 4 HCl + O2 « 2 H2O + 2 Cl2 | 229. | CO + 3 H2 « CH4 + H2O (ж) |
| 217. | NH4Cl (тв) « NH3 + HCl | 230. | 2 CO + SO2 « S (ромб) + 2 CO2 |
| 218. | 2 N2 + 6 H2O (ж) « 4 NH3 + 3 O2 | 231. | CO + Cl2 « COCl2 (г) |
| 219. | 4 NO + 6 H2O(ж) « 4 NH3 + 5 O2 | 232. | CO2 + H2 « CO + H2O (ж) |
| 220. | 2 NO2 « 2 NO + O2 | 233. | СО2 + 4 Н2 « СН4+2 Н2О (ж) |
| 221. | N2O4 « 2 NO2 | 234. | 2 СО2 « 2 СО + О2 |
| 222. | Mg(OH)2 « MgO + H2O (г) | 235. | СН4 + СО2 « 2 СО + 2 Н2 |
| 223. | CaCO3 « CaO + CO2 | 236. | С2Н6 « С2Н4 + Н2 |
| 224. | Ca(OH)2 « CaO + H2O (г) | 237. | С2Н5ОН(ж) « С2Н4 + Н2О (ж) |
| 225. | S (ромб) + 2 H2O(ж) « SO2+2 H2 | 238. | СН3СНО (г) + Н2 « С2Н5ОН (ж) |
| 226. | S (ромб) + 2 CO2 « SO2+2 CO | 239. | С6Н6(ж) + 3 Н2 « С6Н12 (ж) |
| 227. | 2 SO2 + O2 « 2 SO3 (г) | 240. | 2 Mg + CO2 (г) « 2 MgO+C (граф.) |
В задачах (241–250) определить стандартную энтальпию образования веществ, подчеркнутых в уравнениях реакций. Термодинамические данные взять из табл. 3 прил.
| № | Уравнение реакции | D Н реакции, кДж |
| 241. | MgCO3 (к) ® MgO (к) + CO2 (г) | + 101,7 |
| 242. | CS2 (ж) + 3 О2 (г) ® СО2 (г) + 2 SO2 (г) | - 1075,0 |
| 243. | 3 СаО (к) + Р2О5 (к) ® Са3(РО4)2 (к) | - 739,0 |
| 244. | 2 РH3 (г) + 4 О2 (г)® Р2О5 (к) + 3 Н2О (ж) | -2360,4 |
| 245. | СН3ОН(ж) + 3/2 О2 (г) ® СО2 (г) + 2 Н2О (ж) | - 726,78 |
| 246. | SO2 (г) + 2 H2S (г)® 3 S (к) + 2 H2O (ж) | - 234,5 |
| 247. | Na2CO3 (к) + SiO2(к) ® Na2SiO3(к)+ CO2 (г) | + 819,3 |
| 248. | CaO (к) + 3 С (к) ® СаС2 (к) + СО (г) | + 466,0 |
| 249. | Hg(ONC)2 (к) ® Hg (г) + 2 CO (г) N2(г) | + 364,2 |
| Na2O (к) + SiO2 (к) ® Na2SiO3 (к) | - 243,5 |
В задачах (251–257) вычислить, сколько тепла выделится при полном сгорании 1 м3 газообразного вещества до SO2 (г), Н2О (ж), СО2 (г), В2О3 (к), As2О3 (к)
| № задачи | |||||||
| Вещество | В2Н6 | CS2 | H2S | AsН3 | C2Н6 | C2Н4 | C2Н2 |
В задачах (258–266) вычислить, сколько молей веществ, подчеркнутых в уравнениях реакций, прореагировало или образовалось в результате химических превращений, если при этом выделилось 2500 кДж тепла
| № задачи | Уравнение реакции |
| 258. | SiC (к) +2 O2 (г) + 2 NaOH (к) ® Na2SiO3 (к) + СО2 (г) + Н2О (г) |
| 259. | ZnS (к) + 3/2 O2 (г)® ZnO (к) + SO2 (г) |
| 260. | SiO2 (к) + 2 NaOH (к) ® Na2SiO3 (к) + H2O (г) |
| 261. | СаС2 (к) + 2 Н2О (ж) ®Са(ОН)2 (к) + С2Н2 (г) |
| 262. | Si3N4 (к) + 6 Ba(OH)2 (к) ®Ba2SiO4 (к) + 4 NH3 (г) |
| 263. | 2 PH3 (г) + 4 О2 (г) ® Р2О5 (к) + 3Н2О (ж) |
| 264. | СН3ОН(ж) + 3/2 О2 (г) ® СО2 (г) + 2 Н2О (ж) |
| 265. | 4 NH3 (г) + 3 О2 (г) ® 6 Н2О (г) + 2 N2 (г) |
| 266. | CS2 (ж) + 3 О2 (г) ® СО2 (г) + 2 SО2 (г) |
В задачах (267–276), используя термодинамические величины веществ, вычислить для химических реакций изменения энтальпии, энтропии и энергии Гиббса. Определить, в каком направлении возможно протекание реакций
| № задачи | Уравнение реакции |
| 267. | Ве2С(к) + 4 Н2О (ж) « 2 Ва(ОН)2 (к) + СН4 (г) |
| 268. | Mg3N2 (к) + 6 H2O (ж) « 3 Mg(OH)2 (к) + 2 NH3 (г) |
| 269. | Fe2O3 (к) + 2 LiOH (к) « 2 LiFeO2 (к)+ H2O (ж) |
| 270. | 4 Al(OH)3 (к) + 3 CH4 (г) « Al4C3 (к) + 12 H2O (ж) |
| 271. | 3 SiH4 (г) + 4 NH3 (г) « Si3N4 (к) + 12 H2 (г) |
| 272. | TiCl4 (ж) + 2 Mg (к) « Ti (к) + 2 MgCl2 (к) |
| 273. | 3 MgO (к) + 2 Al (к) « 3 Mg (к) + Al2O3 (к) |
| 2 Сu2O (к) + Cu2S (к) « 6 Cu (к) + SO2 (г) | |
| 275. | CaSO4 (к) + CO2 (г) « CaCO3 (к) + SO3 (г) |
| 276. | 4 HCl (г) + O2 (г) « 2Cl2 (г) + 2 H2O (ж) |
В задачах (277–284) рассчитать приблизительно температуру, при которой устанавливается равновесие в обратимых химических реакциях
| № задачи | Уравнение реакции |
| 277. | Li3N (к) + 3 Н2 (г) « 3 LiН (к) + NН3 (г) |
| 278. | GeO2 (к) + 4 HCl (г) « GeCl4 (г) + 2 H2O (г) |
| 279. | V2O5 (к) + 5 Fe (к) « 2 V (к) + 5 FeO (к) |
| 280. | SiCl4 (г) + 2 H2 (г) « Si (к) + 4 HCl (г) |
| 281. | Li2O (к) + 3 C (гр.) « Li2C2 (к) + CO (г) |
| 282. | CaCO3 (к) + 4 С (гр.) « СaС2 (к) + 3 CO (г) |
| 283. | Fe2O3 (к) + CO (г) « 2 FeO (к) + CO2 (г) |
| 284. | WO3 (к) + 3 H2 (г) « W (к) + 3 H2O (г) |
Дата добавления: 2016-08-07; просмотров: 16314;
