Примеры составления условия задач и их решения
Задача 185
Вычислить эквивалентную массу металла, зная, что его хлорид содержит 79,78 % хлора и 20,22 % металла.
Решение:
Согласно закону эквивалентов отношение количества металла и хлора в соединении должно быть равно отношению их эквивалентных масс:
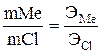 ;
; 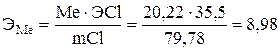 г/моль.
г/моль.
Задача 190
Вычислить эквивалентную массу оксида и металла, если на восстановление 1,80 г оксида израсходовано 0,833 л водорода (н.у.).
Решение:
В тех случаях, когда одно из реагирующих веществ находится в твердом состоянии, а второе – в газообразном, закон эквивалентов может быть выражен так:
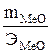 =
= 
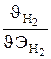 ;
; 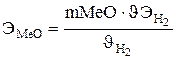 .
.
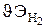 – эквивалентный объем газа – это объем, который занимает 1 эквивалент вещества при данных условиях. Значение эквивалентного объема можно найти, исходя из того, что мольный объем любого газа при нормальных условиях равен 22,4 л/моль. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль:
– эквивалентный объем газа – это объем, который занимает 1 эквивалент вещества при данных условиях. Значение эквивалентного объема можно найти, исходя из того, что мольный объем любого газа при нормальных условиях равен 22,4 л/моль. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль:
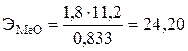 г/моль.
г/моль.
Эквивалентная масса оксида равна сумме эквивалентных масс элемента, образующего оксид, и кислорода: ЭМеО = ЭМе + ЭО ; ЭМе = ЭМеО + ЭО = 24,20 – 8 = = 16,20 г/моль. Эквивалентная масса металла равна 16,20 г/моль.
Задача 196
При растворении 0,5 г метана в кислоте выделилось 0,189 л водорода при температуре 294 К и давлении 101,325 кПа. Вычислить эквивалентную массу металла.
Решение:
Необходимо объем газа привести к нормальным условиям.
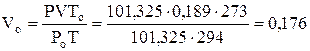 л.
л.
Из закона эквивалентов вытекает, что
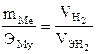 ,
,
подставив значение величин из условия, получим
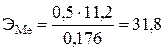 г/моль.
г/моль.
В задачах (160–179) определить эквивалентную массу соединения
(первого) в следующих реакциях:
| 160. | Cr(OH)3 + 2 HCl = CrOHCl2 + 2 H2O |
| 161. | 2 Bi(OH)3 + 3 H2SO4 = Bi2(SO4)3 + 6 H2O |
| 162. | 2 H3AsO4 + 3 Mg(OH)2 = Mg3(AsO4)2 + 6 H2O |
| 163. | 1 Mg(H2PO4)2 + 2 Mg(OH)2 = Mg3(PO4)2 + 4 H2O |
| 164. | KH2PO4 + 2 KOH = K3PO4 + 2 H2O |
| 165. | 2 Fe(OH)3 + H2SO4 = [Fe(OH)2]2SO4 + 2 H2O |
| 166. | H3PO4 + Ca(OH)2 = CaHPO4 + 2 H2O |
| 167. | 2 H2SeO4 + Mg(OH)2 = Mg(HSeO4)2 + 2 H2O |
| 168. | Be(OH)2 + 2 KOH = K2BeO2 + 2 H2O |
| 169. | NaHSO4 + BaCl2 = BaSO4 + NaCl + HCl |
| 170. | CuOHNO3 + HNO3 = Cu(NO3)2 + H2O |
| 171. | Bi(OH)2NO3 + 2 HNO3 = Bi(NO3)3 + 2 H2O |
| 172. | 3 Sn(OH)2 + 2 HNO3 = 3 SnO2 + 2 NO + 4 H2O |
| 173. | 2 NaHSO3 + 2 KOH = Na2SO3 + K2SO3 + 2 H2O |
| 174. | Ca(HCO3)2 + Ba(OH)2 = BaCO3¯ + CaCO3 ¯ + 2 H2O |
| 175. | Cu(OH)2 + 2 NaHSO4 = CuSO4 + Na2SO4 + 2 H2O |
| 176. | H3PO4 + K2CO3 = K2HPO4 + CO2 + H2O |
| 177. | Cu2(OH)2CO3 + 2 H2SO4 =2 CuSO4 + CO2 + 3 H2O |
| 178. | 2 HNO3 + MgCO3 = Mg(NO3)2 + H2O + CO2 |
| 179. | [Zn(OH)]2CO3 + H2SO4 = ZnSO4 + CO2 + 2 H2O |
В задачах (180–189) вычислить эквивалентную массу металла по
процентному содержанию его в соединениях:
| № задачи | Металл, % | Кислород,% | № задачи | Металл, % | Хлор, % |
| 180. | 52,00 | 48,00 | 185. | 20,22 | 79,78 |
| 181. | 68,42 | 31,58 | 186. | 62,55 | 37,45 |
| 182. | 76,47 | 23,53 | 187. | 45,49 | 54,51 |
| 183. | 84,60 | 15,40 | 188. | 73,86 | 26,14 |
| 184. | 92,82 | 7,18 | 189. | 84,96 | 16,04 |
В задачах (190–195) вычислить эквивалентные массы оксида и металла, если на восстановление определенного количества оксида металла израсходованы следующие объемы водорода (н.у.):
| № задачи | Масса оксида, г | Объем водорода, л | № задачи | Масса оксида, г | Объем водорода, л |
| 190. | 1,80 | 0,833 | 193. | 3,4 | 2,24 |
| 7,09 | 2,24 | 194. | 5,6 | 1,742 | |
| 4,7 | 0,82 | 195. | 10,0 | 5,6 |
В задачах (196–204) вычислить эквивалентную массу металла, если определенное количество его присоединяет или вытесняет следующие объемы газов:
| № задачи | Масса, металла,г | Взаимодействие | Объем газа, л | Темпера- тура, К | Давление к×Па |
| 196. | 0,5 | Вытесняет Н2 | 0,189 | 101,325 | |
| 197. | 0,207 | Вытесняет Н2 | 0,274 | 100,000 | |
| 198. | 1,37 | Вытесняет Н2 | 0,500 | 101,325 | |
| 199. | 8,34 | Присоединяет О2 | 0,680 | 101,325 | |
| 200. | 0,5 | Присоединяет Сl2 | 0,33 | 101,325 | |
| 201. | 1,00 | Присоединяет О2 | 0,512 | 101,325 | |
| 202. | 1,00 | Присоединяет Cl2 | 0,42 | 99,3 | |
| 203. | 3,24 | Вытесняет Н2 | 4,03 | 101,325 | |
| 204. | 0,673 | Присоединяет О2 | 0,310 | 100,000 |
Дата добавления: 2016-08-07; просмотров: 1987;
