Інші схеми систематичного аналізу катіонів
83) Сірководнева схема систематичного аналізу катіонів
а) назвіть групові реагенти і склад груп;
б) які властивості об’єднують катіони у групи?
84) Фосфатно-амоніакова схема систематичного аналізу катіонів
а) назвіть групові реагенти і склад груп;
б) які властивості об’єднують катіони у групи?
85) Які переваги та недоліки кислотно-основної, сірководневої та фосфатно-амоніакової схем систематичного аналізу?
86) Які орґанічні реагенти застосовують у якісному аналізі катіонів?
87) За якими реакціями виявляють катіони дробним методом?
Систематичний якісний аналіз аніонів
88) Які особливості якісного аналізу аніонів порівняно з аналізом катіонів?
89) Назвіть групові реагенти і склад груп систематичного аналізу аніонів.
90) Що таке «водяна витяжка» і «содова витяжка»?
91) Попередні випробування на присутність окисників, відновників, летких та нестійких сполук. Їх необхідність та суть.
92) Схема аналізу суміші аніонів 1-ї аналітичної групи.
93) Схема аналізу суміші аніонів 2 та 3-ї аналітичних груп.
94) Схема аналізу суміші аніонів 4 та 5-ї аналітичних груп.
95) За якими реакціями виявляють аніони CO32-; PO43-; CrO42-; BO2-; Cl-; Br-; I‑; NO2-; NO3-. Обґрунтуйте їх умови.
96) Які аніони перешкоджають виявленню PO43- за реакцією з молібдатом амонію дробним методом?
97) Які аніони можна виявити реакцією «сірчане печиво»? Як її застосувати, щоб виявити іон SO42-.
98) Чому іон I- окиснюється хлорною водою до IO3-, а Br--- іон не окиснюється до BrO3-?
99) Який склад реактивів Фаургольта та Грісса? Які продукти реакцій?
Модуль 1.
Приклади розв’язання задач
1.
Запишіть значення констант наступних рівноваг:
1) H2AsO4- D HAsO42- + H+;
1) AgCNS↓ + 2CNS− D Ag(CNS)3 2-;
2) SrCrO4↓ + H+ D HCrO4− + Sr2+.
Розв’язок:
1) H2AsO4 D HAsO42- + H+.
Це константа дисоціації мишякової кислоти за другим ступенем. З таблиць констант знаходимо:
AsO43‑, арсенат‑іон
H+ lg KH1 = 11,50, DH = ‑27,6; lg KH2 = 6,96, lg KH3 = 2,24.
Враховуємо зв'язок між константами дисоціації та константами протонування:
Ka2 = KH2-1 =10-6,96
ЗДМ: Ka2 = 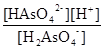 .
.
2) AgCNS↓ + 2CNS− D Ag(CNS)3 2-
Рівновага складається з двох процесів:
1) Рівновага розчинення осаду з константою добутку розчинності
1. AgCNS↓ D Ag+ + CNS-, KS = 10-11,97
2) рівновага комплексоутворення з загальною константою b3
2. Ag+ + 3CNS- Û Ag(CNS)32-, b3 = K1·K2·K3 = 109,5
 Сумарний процес:
Сумарний процес:
AgCNS↓ + Ag+ + 2 3CNS-Û
Û Ag+ + CNS-+ Ag(CNS)32-, KS · b3 = 10-2,47
(константа сумарного процесу дорівнює добутку
KS · b3 = 10-11,97 · 109,5 = 10-2,47)
ЗДМ: 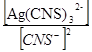
3) SrCrO4↓ + H+ D HCrO4- + Sr2+.
Це рівняння складається з:
рівноваги розчинення осаду з константою добутку розчинності
SrCrO4↓ D Sr2+ + CrO42-, KS =10-4,65
та рівноваги протонування: за першим ступенем
CrO42- + H+ D HCrO4- , KН1 = βH1 = 103,17
SrCrO4↓ + H+ D HCrO4- + Sr2+, KS · KН1 = 10-4,65 · 103,17 =
=10-1,48 = 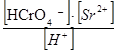
2. Який з осадів випаде першим, якщо осаджувати суміш катіонів однакових концентрацій, с = 0,1 моль/л, (Ag+; Hg22+; Pb2+) IO3-?
Розв’язок:
Запишемо рівняння закону діючих мас
AgІО3↓ D Ag+ + ІО3-, KS = [Ag+ ] + [ІО3-] = 10-7,51;
Hg2(IO3)2↓ D Hg22+ + 2 ІО3-, KS = [Hg22+]·[ІО3-]2 = 10-17,89;
Pb(IO3)2↓ D Pb2+ + 2 ІО3-, KS = [Pb2+]·[ІО3-]2 = 10-12,61;
[IO3-]Ag+ = KS /[Ag+] = 10-7,51/10-1 = 10-6,51;
[IO3-]Hg2+ = (KS / [Hg2+])1/2 = (10-17,89/10-1)1/2 = 10-8,44;
[IO3-]Pb2+ = (KS /[Pb2+])1/2 = (10-12,61/10-1)1/2 = 10-5,65.
Відповідь: першим буде випадати Hg2(IO3)2↓, другим − AgІО3↓, третім − Pb(IO3)2↓.
3. Обчисліть рН насиченого розчину СО2, якщо його розчинність при 20 0С складає 2,2 г/л.
Дано:
S = 2,2 г/л
_____________________
рН - ?
Розв’язок: Для розрахунку молярної концентрації використовуємо рівняння: 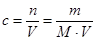 , де, n – кількість речовини, m − маса, M = 44 − молярна маса,
, де, n – кількість речовини, m − маса, M = 44 − молярна маса, 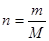 , V − об’єм розчину
, V − об’єм розчину
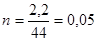 ,
, 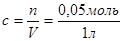 =0,05 моль/л,
=0,05 моль/л,
H2CO3 D СО2+ H2O
H2CO3 D H+ + HCO3-, KН2 = 10-6,35;
C 0.05 - -
DC -x +x +x
[ ] 0.05-X X x
ЗДМ: 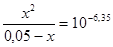 ;
;
x » 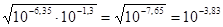 ,
,
рН = -lg 10-3,83 = 3,83.
Відповідь: рН = 3,83.
Задачі для самостійного розв’язання
Вправа 1.Обчисліть логарифми констант рівноваг
(1) Al(OH)3↓ + (j-3) OH-D Al(OH)j3-j , для j = 1-4;
(2) Zn(OH)2↓ + (j-2) OH-D Zn(OH)j2-j, для j = 1-4;
(3) Fe(OH)3↓ + (j-3) OH-D, Fe(OH)j3-j , для j = 1-4;
(4) Ni(OH)2↓ + (j-2) OH-D Ni(OH)j2-j, для j = 1-4;
(5) Cu(OH)2↓ + (j-2) OH-D Cu(OH)j2-j, для j = 1-4;
(6) Cd(OH)2↓ + (j-2) OH-D Cd(OH)j2-j, для j = 1-4;
(7) AgOH↓ + (j-1) OH-D Ag(OH)j1-j, для j = 1-2.
Вправа 2.Знайти лінійні комбінації реакцій та величини логарифмів їх констант ЗДМ, що пояснюють такі спостереження:
1) AgCl(s) розчиняється у водяному NH3 ;
2) PbSO4(s) розчиняється у розчині NaOH;
3) BaSO4(s) перетворюється у BaCO3(s) дією розчину Na2СO3;
4) синій розчин Cr(OH)4‑ переходить у жовтий дією H2O2 у лужному середовищі;
5) BiI3(s) дає жовто-оранжевий розчин із надлишком розчину KI;
6) HgI2(s) дає жовто-оранжевий розчин із надлишком розчину KI;
7) білий осад Bi(OH)3(s) переходить у чорний дією розчину SnCl2 у середовищі HCl;
8) із розчину Hg(NO3)2 випадає сірий осад дією розчину NH2OH×HCl у суміші HCl й надлишку водяного NH3 ;
9) із розчину Hg(NO3)2 випадає сірий осад дією розчину H2O2 у суміші HCl й надлишку водяного NH3 ;
10) Cu(OH)2(s) розчиняється у водяному NH3 ;
11) із суміші розчинів Cu(NO3)2 та KI випадає забарвлений осад, а з розчину можна вилучити І2 у розчинник СCl4, що не змішується із водою і І2 у якому дає фіолетовий розчин.
Вправа 3. Обчисліть рН розчинів:
1) фосфатної кислоти, H3PO4, якщо c(H3PO4) = 0,010 моль/л;
2) гідрогенсульфіду (сірководневої кислоти), H2S, якщо c(H2S) =
= 0,10 моль/л;
3) розчину CO2 (вугільної кислоти), c(CO2) = 0,10 моль/л;
4) розчину SO2 (сірчистої кислоти), c(SO2) = 0,10 моль/л;
5) цитринової (лимонної) кислоти, C6H8O7, або H3L, c(H3L) =
= 0,010 моль/л;
6) амоніаку, NH3, якщо c(NH3) = 0,010 моль/л;
7) метиламіну, CH3NH2, c(CH3NH2) = 0,010 моль/л;
8) піридину, C5H5N, c(C5H5N) = 0,010 моль/л;
9) ацетату натрію (сильної солі), NaAc, c(Na+) = c(Ac‑) = 0,010 моль/л;
10) форміату натрію (сильної солі), c(Na+) = c(НСОО‑) = 0,010 моль/л.
Вправа 4. Обчисліть за балансом реакцій розчинність у воді, враховуючи кислотно-основні перетворення:
(1) Ag2CO3↓+H2O D AgOH +HCO3-;
(2) Ag3PO4 ↓+3H2O D 3AgOH +HPO42-+2H+;
(3) BaCO3 ↓+H2O D Ba2+ + HCO3-;
(4) PbCO3 ↓+H2O D Pb(OH)+ + HCO3-;
(5) ZnS (b)↓+H2O D Zn(OH)+ + HS-;
(6) CaSO3 ↓+H2O D Ca2+ + HSO3-;
(7) FeS ↓+H2O D Fe(OH)+ + HS-;
Вправа 5. До розчину, що містить суміш катіонів:
1) ( Ag+, Ca2+, Pb2+) з концентрацією 0,01 моль/л додають аніон-осаджувач − карбонат (CO32-);
2) ( Ag+, Cu2+, Sr2+) з концентрацією 0,01 моль/л додають аніон-осаджувач − карбонат (CO32-);
3) ( Ag+, Hg22+, Pb2+) з концентрацією 0,01 моль/л додають аніон-осаджувач − хлорид (Cl-);
4) (Ba2+, Sr2+ Ca2+) з концентрацією 0,01 моль/л додають аніон-осаджувач − фторид (F-);
5) (Ag+, Ba2+, Ca2+) з концентрацією 0,01 моль/л додають аніон-осаджувач − сулфіт (SO32-);
1. Який із катіонів буде осаджуватись першим, другим, третім?
2. Вкажіть концентрації всіх катіонів на момент початку осадження кожного з них.
Вправа 6. Обчислити концентрацію іона:
(1) [Fe3+] в 0,01 моль/л розчину FeCl3, до якого було додано 0,1 моль KCNS;
(2) [Cd2+] в 0,01 моль/л розчину Cd(NO3)2, до якого було додано 0,1 моль KCN;
(3) [Ni2+] в 0,1 моль/л розчину Ni(NO3)2, до якого було додано 1,0 моль NH3;
(4) [Cu2+] в 0,05 моль/л розчину Cu(NO3)2, до якого було додано 1,0 моль NH3;
(5) [Hg2+] в 0,1 моль/л розчину Hg(NO3)2, до якого було додано 1,0 моль KI.
Кількісний аналіз
Методи хімічного аналізу
Дата добавления: 2016-08-07; просмотров: 959;
