Приклади обчислень рівноважних концентрацій розчинів за схемою Комаря М. П.
Розглянемо приклад 2, який наведено в розділі «Метод матеріального балансу»
Розв’язання. При розчиненні солі HCOOAg у воді – у розчині будуть такі переважаючі компоненти: Ag+, HCOO-, H2O.
Запишемо всі рівноваги в розчині і наведемо значення констант ЗДМ:
H2O D H++OH- lgKW = -14
Ag+ + H2O D AgOH + H+ lgβОH1KW = -12
Аg++2H2O DAg(OH)2- +2H+ lgβОH2KW2 = -24
HCOO- + H2O D HCOOН +OH- lgβH1KW = -10.255
Серед наведених реакцій для останньої – реакції гідролізу форміат-іонів – константа ЗДМ (10-10,255) найбільша. Розглянемо останню рівновагу детальніше.
У першій строчці після рівняння реакції вказують вихідні дані, у другій – координату реакції, а в третій – рівноважний склад (x – рівноважна концентрація продуктів реакції)
HCOO- + H2O D HCOOН +OH-
1) С0 0,1 - -
2) ΔС -x x x
3) [ ] 0,1-x x x
Підставляють рівноважні концентрації з 3-ї строчки в рівняння ЗДМ:
10-10,255 =  =
= 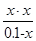 .
.
Розвязуючи квадратне рівняня, знаходять рівноважні концентрації [HCOOН] та [OH-].
х2 + 10-10,255х – 10-11,255 = 0.
Якщо прийняти умову x<<0,1,
то х2 = 10-11,255 і х = 10-5,647моль/л (умова справджується, значить розв’язання правильне).
Таким чином, [HCOOН]= [OH-]=10-5,65 моль/л;
[HCOO-] = 0,1–10-5,65 ≈ 0,1 моль/л;
[Ag+] ≈ С(Ag+) = 0,1 моль/л;
[H+] = KW/[OH-] =10-14/10-5,65 = 10-8,35моль/л, pH = 8,35;
[AgOH] = [Ag+]βОH1KW/[H+] = 0,1 10-12 /10-8,35 = 10-4,65 моль/л.
Відповідь: [HCOOН]= [OH-] = 10-5,65 моль/л, pH = 8,35 [HCOO-]= = 0,1 моль/л; [Ag+] = 0,1 моль/л, [H+] =10-8,35 моль/л, pH = 8,35, [AgOH] = 10-4,65 моль.
Розглянемо ще кілька достатньо простих прикладів з використанням концентраційних констант.
Приклад 3. Розрахувати рН та рівноважний склад розчину оцтової кислоти з концентрацією 0,1 моль/л.
Розв’язання. У розчині будуть такі переважаючі компоненти: СН3COOН (оцтова кислота), H2O.
Запишемо рівноваги в розчині і наведемо значення термодинамічних констант ЗДМ:
H2O D H++OH- lgKW = -14
СН3COOН D СН3COO- + H+ lgKa = -lgβH1 = -4,76
Зрозуміло, що константа другої рівноваги значно вища. Тому детально розглядаємо рівновагу дисоціації оцтової кислоти.
СН3COOН D СН3COO- + H+
1) С0 0,1 - -
2) ΔС -x x x
3) [ ] 0,1-x x x
Після підстановки рівноважних концентрацій з 3-ї строчки в рівняння ЗДМ:
Ка1 = 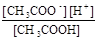 =
= 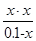 = 10-4,76.
= 10-4,76.
Якщо прийняти умову x<<0,1, то х2 = 10-5,76 і
х = 10-2,88 моль/л (умова справджується, значить розв’язання правильне).
Таким чином,
[СН3COO-] = [H+] = 10-2,88 моль/л; pH=2,88. [OH-] = KW/[H+] =10-14/10-2,88 = 10-11,12 моль/л, [СН3COOH]=0,1- 10-2,88 = 0,09868 моль/л.
Обчислимо значення концентраційних констант.
Іонна сила розчину: I = 1/2([H+]·12 + [СН3COO-]·12) = 10-2,88. Іони ОН- не вносять значимого внеску в іонну силу.
Коефіцієнт активності однозарядного іона:
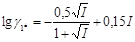 =
= 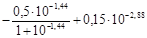 = -0,0173;
= -0,0173;
lg Kc = lg K −  lg (
lg ( 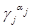 ) = -4,76 + 1·(-0,0173) + 1·(-0,0173)=-4,79;
) = -4,76 + 1·(-0,0173) + 1·(-0,0173)=-4,79;
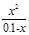 = 10-4,79; Якщо x<<0,1 то x2 = 10-5,79, а x = 10-2,9.
= 10-4,79; Якщо x<<0,1 то x2 = 10-5,79, а x = 10-2,9.
У результаті отримуємо:
[СН3COO-] = [H+] = 10-2,9 моль/л; pH=2,9. [OH-] = KW/[H+] = 0-14/10-2,9 = 10-11,1 моль/л, [СН3COOH]=0,1– 10-2,9 = 0,09874 моль/л.
Відповідь: [СН3COO-] = [H+] = 10-2,9 моль/л; pH = 2,9.
[OH-]=10-11,12 моль/л, [СН3COOH] = 0,09874 моль/л.
Примітка. Як видо при співставленні, рівноважні концентрації, розраховані з використанням термодинамічної та концентраційної константи, відрізняються мало.
Приклад 4. Розрахувати рН та рівноважний склад розчну гідроксиду барію з концентрацією 0,01 моль/л.
Розв’язання: у розчині будуть такі переважаючі компоненти: [Ba2+], [OH-], H2O.
Запишемо рівноваги в розчині і наведемо значення констант ЗДМ:
H2O D H++OH- lgKW = -14
Ba2+ + OH- D Ba(OH)+ lgβOH1 = 0,5
Оцінимо іонну силу розчину і концентраційні константи.
I = 1/2([Ba2+]·22 + [OH-]·12 =1/2(0,01·4 + 0,02·12 ) = 0,03.
Обчислимо значення коефіцієнта активності однозарядного іона:
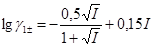 =
= 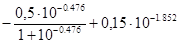 = 0,0045 – – 0,0738 = -0,0693; g1±=0,852.
= 0,0045 – – 0,0738 = -0,0693; g1±=0,852.
Концентраційна константа первої рівноваги:
lg Kwc = lg Kw –lg gH+ – lg gOH- = -14–2·(-0,0693)=-13,86
Концентраційна константа другої рівоваги:
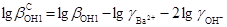 ; lggBa2+=22·lgg1±=-0,2772;
; lggBa2+=22·lgg1±=-0,2772;
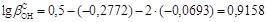 .
.
розглядаємо детально останню рівновагу
Ba2+ + OH- D Ba(OH)+ lgβOH1 = 0,916
1) С0 0,01 0,02 -
2) ΔС -x -x x
3) [ ] 0,01-x 0,02-x x
Після підстановки рівноважних концентрацій у ЗДМ
100,916 = 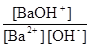 =
= 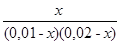
2·10-4 − 2·10-2x − 1·10-2x + x2 = 0,1213x
x2 − 0,1513x + 2·10-4 = 0
x1 = 0,1499, x2 = 1,28·10-3
У результаті маємо:
x2 = [ Ba(OH)+] = 1,28·10-3 моль/л;
[Ba2+] = 0,01−1.28·10-3 = 8,72·10-3 моль/л;
[OH-] = 0,002−1.28·10-3 = 1,87·10-2 моль/л;
[H+] = KW/ [OH-]= 10-13,86/10-1,728 =10-12,13 моль/л. pH = 2,13.
Відповідь: [Ba2+] = 8,72·10-3 моль/л; [OH-] = 1,87·10-2 моль/л;
[H+] = 10-12,13 моль/л. pH =12,13.
Приклад 5. Розрахувати рівноважний склад і рН насиченого розчину гідроксиду кальцію при наявності NaOH з концентрацією 0,1 моль/л.
Розв’язання. У насиченому розчині справджується константа «добуток розчинності» (Ks).
У вихідному розчині (c(NaOH) = 0,1) іонна сила I = 0,1 (перевірте самостійно).
Коефіцієнт активності однозарядного іона:
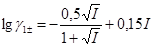 =
= 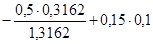 = -0,1051.
= -0,1051.
Коефіцієнти активності іонів-учасників рівноваги:
lggCa2+ = 22·lg g1± = 4 ·(-0,1051)=-0,4204;
lggOH- = lg g1±= -0,1051.
Обчислимо значення логарифму концентраційної константи
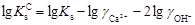 = ‑5,19+0,420+0,105=-4,665;
= ‑5,19+0,420+0,105=-4,665;
Ca(OH)2↓ D Ca2+ + 2OH- lgKs = -4,665
С0 0,1
ΔС -x x x
[ ] x 0,1+ x
10-5,19=[ 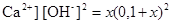 .
.
При умові x<<0,1 маємо: x=[ Ca2+]=10-4,665/0,01=10-2,665 моль/л.
[OH-] = 0,1+10-2,665 = 0,1022 моль/л.
[H+] = KW/ [OH-] = 10-14/10-0,991 = 10-13,009моль/л, pH = 13
[Na+] = 0,1 моль/л.
Відповідь:[Ca2+] = 0,0696 моль/л; [OH-] = 0,1022 моль/л; [Na+] = 0,1 моль/л, [H+] = 10-13,009моль/л, pH = 13.
Приклад 6. Розрахувати рН та рівноважний склад розчину гідрокарбонату натрію з концентрацією 0,1 моль/л.
Розв’язання. У розчині кислої солі (переважаючі компоненти – Na+, HCO3-, H2O) мають місце такі рівноваги:
HCO3- D CO32-+H+ lgKa2=-lgβH1 =-10,33;
HCO3- +H2OD H2CO3+OH- lgKw+lgKH2=-14+6,35=-7,65;
2HCO3-D H2CO3 + CO32- lgKH2-lgKH1=6,35–10,33=-3,98;
H2O D H++OH- lgKW=-14.
розглядаємо детально рівновагу
2HCO3-D H2CO3 + CO32- lgKH2/KH1 = -3,98.
Виконаємо розрахунки концентраційної константи.
іонна сила розчину: I = ([HCO3-]12 +[Na+]12 )/2 = 0,1.
Обчислимо значення коефіцієнта активності однозарядного іона:
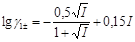 =
= 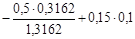 =-0,1051.
=-0,1051.
Значить lggCO32- =22·lg g1±=4 ·(-0,1051) = -0,4204;
lggHCO3-= lg g1±= -0,1051.
Обчислимо значення логарифму концентраційної константи
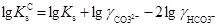 =-3,98+0,420−0,105=-3,665.
=-3,98+0,420−0,105=-3,665.
Продовжуємо аналіз рівноваги
2HCO3-D H2CO3 + CO32- lgKСH2/KH1 = -3,665;
С0 0,1
ΔС -2x x x
[ ] 0,1-2x x x
Після підстановки рівноважних концентрацій у ЗДМ
10-3,665 = 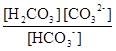 =
= 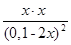 .
.
10-1,833 = 0,0147=  , 0,00147=1,0294 x.
, 0,00147=1,0294 x.
х = [H2CO3 ] = [CO32-] = 1,43·10-3 моль/л.
[HCO3-] = 0,1− 2[CO32-] = 0,0971 моль/л.
[H+] = 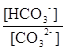 10-10,33 =10-8,5 рН=8,5.
10-10,33 =10-8,5 рН=8,5.
[OH-] = KW/[H+] =10-14/10-8,5=10-5,5моль/л.
Відповідь: [HCO3-] = 0,0971 моль/л; [H2CO3 ] = [CO32-] = 1,43·10-3 моль/л;
[H+] = 10-8,5; рН = 8,5; [OH-] =10-5,5 моль/л.
Буферні розчини
Якщо для розчину характерна властивість зберігати значення будь-якої рівноважної концентрації (активності) при його розведенні або додаванні до нього інших реактивів, то такий розчин називають буферним відносно цього компонента або показника, який розраховують через рівноважну концентрацію (активність) компонента. Відомі буферні розчини рН (pH = -lg[H+]), pM (pM = -lg[Mμ+]), pe- (pe = -lg[e-] = f([Ox]/[Red]). Останні з названих підтримують значення окислювально-відновного потенціалу який є мірою рівноважної концентрації (активності) незв’язаних електронів.
Біологічні системи проявляють буферні властивості відносно рН і ре-.
властивість протидіяти змінам зовні називають буферністю. Буферність вимірюють буферною ємністю. Наприклад, для буферних розчинів рН буферну ємність розраховують за рівнянням:
w = DC(H+)/DpH = (при (DС"0)) = dC(H+)/dpH. Класичне визначення – це концентрація сильної кислоти (або лугу), додавання яких змінює рН на ±1,0. Буферний розчин рН містить два компоненти, що перетворюються один в одного, приєднуючи або втрачаючи протон. Для розчину слабкої кислоти й її солі (наприклад, оцтової) справджується константа дисоціації:
CH3COOH D CH3COO- + H+ Ka = 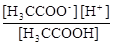 .
.
Після логарифмування маємо: pH = pKa +lg 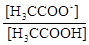 .
.
Значення водневого показника такого розчину визначається значенням константи дисоціації та співвідношенням рівноважних концентрацій кислоти та її аніону. При введенні в розчин слабкої кислоти та солі цієї ж кислоти рівноважні концентрації кислоти й аніона відрізняються від введених на незначну величину. Якщо змінювати співвідношення концентрацій від 1:100 до 100:1 можна змінювати рН розчину від рКа – 2 до рКа + 2. Саме в цьому діапазоні (рКа ± 2) на практиці готують буферні розчини рН.
Наприклад: нижченаведені значення рКа слабких кислот:
рКа(CH3COOH D CH3COO- + H+) = 4,76;
рКа(NH4+ D NH3+ H+ ) = 9,24;
рКа1(H3PO4 D H2PO4- + H+) = 2,15;
рКа2(H2PO4- D HPO42- + H+) = 7,20;
рКа2(HPO42- D PO43- + H+) = 12,35.
Обчислимо діапазони рН, в яких можна приготувати відповідні буферні розчини. Оцтово-ацетатні буферні розчини можна приготувати в діапазоні рН = 4,76 ± 2 = 2,76 – 6,76. Амонійно-аміакові буферні розчини готують у діапазоні рН = 9,24 ± 2 = 7,24 – 11,246. А фосфатні буферні розчини можна приготувати в діапазонах рН = pKa1 ± 2 = 0,15 – 4,15; рН = pKa2 ± 2 = 5,2 – 9,2; рН = pKa3 ± 2 = 10,35 – 14.
Слід звернути увагу на те, що в сильнокислому (рН≤2) та сильнолужному (рН≥ 12) середовищах на практиці розчини слабких кислот не використовують. При необхідності такі середовища створюють розчинами сильних кислот та сильних основ (лугів).
Дата добавления: 2016-08-07; просмотров: 1069;
