Класифікація розчинів. Осмос. Осмотичний тиск.
Розчини – гомогенна система, яка складається з двох чи декількох речовин, причому речовина, що знаходиться в більшій кількості – розчинник.
Біохімічні системи – це відкриті термодинамічні системи.
Дифузія – процес переносу речовини, в результаті якого встановлюється рівномірний розподіл концентрацій внаслідок хаотичного теплового руху молекул, атомів та іонів.
2. Осмос – однобічна дифузія молекул розчинника через напівпроникаючу мембрану в розчин із розчину з низькою концентрацією в розчин з високою концентрацію.
Осмотичний тиск – гідростатичний тиск, який треба прикласти до розчину, щоб затримати осмос.
Закон ВАНТ ГОФФА: осмотичний тиск розбавлених розчинів неелектролітів прямо пропорційний молярній концентрацій розчиненої речовини і абсолютній температурі.
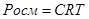 , де С – молярна концентрація
, де С – молярна концентрація
R – стала; 8, 31
Т – температура; 273
Для розчинів з більш високою концентрацією закон Вант Гоффа застосовується, якщо молярну концентрацію замінити на момельну.
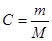
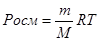 , де m – маса розчиненої речовини
, де m – маса розчиненої речовини
М – молярна маса
Осмотичний тиск постійний в організмі і для організму характерний ізоосмос.
Види розчинів:
Обмінні процеси в організмі, в клітинах, тканинах відбуваються у фізрозчині.
Фізрозчин – це коли Росм клітини дорівнює Росм оточуючого середовища. В нормі це 0, 89 % NaCl. В хімії це ізотонічний розчин. Це такий тиск, який не справляє тиску на клітину.
Росм розчину < Росм клітини, це те, що меньш 0,89% - гіпотонічні розчини. Вода із оточуючого середовища всасується в клітину, клітина розбухає, збільшується в розмірах. Таке явище називають гемоліз, явище ендоосмос.

Коли Росм розчину > Росм клітини – гіпертонічний розчин. Клітина зморщується, зменшується – плазмоліз чи екзосмос.
Осмотичний тиск лімфи, крові, ліквору складає: 0,66 – 0,8 мПа. Для крові людини тиск складає 686,8 – 737,3 кПа
Онкотичний тиск – це доля осмотичного тиску в біологічних рідинах, що створюється наявність в них високомолекулярних сполук – білки, полісахариди, нукл. кислоти. Цей тиск приймає участь в розподіленні води через капіляри. Швидкість фільтрації через капіляри визначається різницею між онкотичним тиском білка плазми крові і гідростатичного тику крові, що створюється роботою міокарда. Онкотичний тиск змінюється при захворюваннях печінки, нирок, серцево-судинної системи. Це пов’язано з пониженням білок-синтезуючої функції печінки і при білковому голоданні. При пониженому осмотичному тиску виникає блювота, судороги і можливо смерть. При підвищеному осмотичному тиску – перерозподіл води в організмі і виникненні відтікань в підшкірній клітчатці.
3.Закони Рауля:
1 закон: тиск насичений пара розчину над розчином дорівнює його тиску званого чистим розчинником, помножену на молярну долю розчинника в розчині.
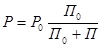 , де Р - тиск насичений пара розчину над розчином
, де Р - тиск насичений пара розчину над розчином
Р0 - тиск насичений пара розчину над чистим розчином
П0 – число молей розчинника
П – число молей розчину
Відносне зниження тиску насиченого пара розчину над розчином дорівнює молярній долі розчиненої речовини в розчині.
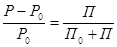
2 закон: пониження температури замороження чи підвищення температури кипіння розчинів прямо пропорційно молярній концентрації розчинів.
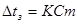 , де К - кріоскопічна константа; К Н2О=1,86
, де К - кріоскопічна константа; К Н2О=1,86
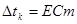 , де Е – ебуліоскопічна константа; Е Н2О=0,52
, де Е – ебуліоскопічна константа; Е Н2О=0,52
Для розчинів електролітів закон Вант Гоффа не дотримується т.я. дослідне значення Росм більше вирахуваного і тоді ми застосовуємо ізотонічний коефіцієнт (і). Він показу, у скільки разів досліджуване Росм більше теоретично вирахуваного.
| <== предыдущая лекция | | | следующая лекция ==> |
| Рівні вивчення обміну речовин | | | Тема: Возбудимые ткани. Кодирование информации в организме. |
Дата добавления: 2016-09-20; просмотров: 2210;
