Зразок запису результатів дослідження властивостей об’єктів у лабораторному журналі
| Номер досліду | Об’єкт вивчення | Операція | Результат спостереження | Висновки та рівняння реакцій |
| 1.1.1 | Ag+ | 3 моль/л HCl | Pбілий | Ag+ + Cl‑ D AgCl ¯, ‑ lg Ks = 9,74 |
| 1.1.2 | AgCl ¯ | 12 моль/л HCl | Pбілий ® F | AgCl ¯ D Ag+ + Cl‑ , lg Ks = ‑ 9,74 Ag+ + 3 Cl‑ D AgCl32‑, lg b3 = 6,0, AgCl ¯ + 2 Cl‑ D AgCl32‑, lg Ks3 = lg Ks + lg b3 = ‑ 3,74 |
| AgCl32‑, 12 моль/л HCl | Розведено водою | Pбілий | Положення рівноваги попередньої реакції зміщується ліворуч, оскільки у ЗДМ, [AgCl32‑] / [Cl‑] 2 = Ks3 знаменник, зі ступенем 2, із розведенням розчину зменшується швидше, ніж чисельник. | |
| 1.1.3 | AgCl ¯ | моль/л NH3 | Pбілий ® F |  1 AgCl ¯DAg++Cl‑, lg Ks = ‑ 9,74
1 Ag++2NH3DAg(NH3)2+, lgb2=7,22
AgCl¯ + 2 NH3 D Ag(NH3)2+ + Cl‑,
lg K = lg Ks + lg b2 = ‑ 2,52 1 AgCl ¯DAg++Cl‑, lg Ks = ‑ 9,74
1 Ag++2NH3DAg(NH3)2+, lgb2=7,22
AgCl¯ + 2 NH3 D Ag(NH3)2+ + Cl‑,
lg K = lg Ks + lg b2 = ‑ 2,52
|
| Ag(NH3)2+ Cl‑ | HNO3 | Pбілий |  1 Ag(NH3)2+ D Ag+ +2NH3 ,‑lg b2=‑ 7,22 2 H+ + 2 NH3 D NH4+ , lg KН = 9,24 1 Ag+ + Cl‑ D AgCl ¯, ‑ lg Ks = 9,74
Ag(NH3)2++2Н++ Cl‑ DAgCl¯ +2NH4+ , 1 Ag(NH3)2+ D Ag+ +2NH3 ,‑lg b2=‑ 7,22 2 H+ + 2 NH3 D NH4+ , lg KН = 9,24 1 Ag+ + Cl‑ D AgCl ¯, ‑ lg Ks = 9,74
Ag(NH3)2++2Н++ Cl‑ DAgCl¯ +2NH4+ ,
 lgK = ‑lg b2 + 2lg KН – lg Ks = 21,0 lgK = ‑lg b2 + 2lg KН – lg Ks = 21,0
| |
| Ag(NH3)2+ Cl‑ | KI | P світло‑ жовтий | 1 Ag(NH3)2+ D Ag+ + 2NH3 , ‑lg b2=‑7,22 1 Ag+ +I‑ DAgI¯ ‑lg Ks (Ag+, I‑) = 16,08 Ag(NH3)2+ +IDAgI¯+2NH3, ‑lg b2-lg Ks= 8,86 |
| Номер досліду | Об’єкт вивчення | Операція | Результат спостереження | Висновки та рівняння реакцій | ||||||
| 1.1.4 | Ag+ | NaOH | Pбурий |  Ag+ + OH‑ D (1/2) Ag2O ¯ + (1/2) H2O, ‑lg Ks (Ag+, OH‑) = 7,71 Ag+ + OH‑ D (1/2) Ag2O ¯ + (1/2) H2O, ‑lg Ks (Ag+, OH‑) = 7,71
| ||||||
| Ag2O ¯ | HNO3 | Pбурий ® F | 1 (1/2) Ag2O ¯ + (1/2) H2O D Ag+ + OH‑, lg Ks (Ag+, OH‑) = ‑ 7,71, 1 H+ + OH‑ D H2O, ‑ lgKw = 14,00, (1/2) Ag2O ¯+ H+ DAg+ + H2O, lg *Ks=7,29 | |||||||
| Ag+ | K2CrO4 | P червоно-бурий | 2 Ag+ + CrO42‑ D Ag2CrO4 ¯, ‑ lg Ks (2 Ag+, CrO42‑) =11,92 | |||||||
| Ag2CrO4 ¯ | HNO3 | Pчервоно‑бурий |  1 Ag2CrO4 ¯ D 2 Ag+ + CrO42‑ , lg Ks (2 Ag+, CrO42‑) = ‑ 11,92, 1 H+ + CrO42‑DHCrO4‑, lg KH1 = 5,74 [I=1], 1 H+ + HCrO4‑ DH2CrO4,lg KH2 = ‑ 0,7 [I=1] 1 Ag2CrO4 ¯ D 2 Ag+ + CrO42‑ , lg Ks (2 Ag+, CrO42‑) = ‑ 11,92, 1 H+ + CrO42‑DHCrO4‑, lg KH1 = 5,74 [I=1], 1 H+ + HCrO4‑ DH2CrO4,lg KH2 = ‑ 0,7 [I=1]
| |||||||
| Ag+ | Na2S | Pчорний | 2 Ag+ + S2‑ D Ag2S ¯ ‑lg Ks (2 Ag+, S2‑)= 50,1 | |||||||
| Ag2S ¯ | HNO3, нагрівання | Pчорний ® F |  3 Ag2S ¯ D 2 Ag+ + S2‑ , lg Ks (2 Ag+, S2‑) = ‑ 50,1, 3 S2‑ ‑ 2 e‑ D S ¯ lg K = 16,5, 2 NO3‑+4H+ + 3e‑DNO +2H2O, lg K = 48,7 3 Ag2S ¯ D 2 Ag+ + S2‑ , lg Ks (2 Ag+, S2‑) = ‑ 50,1, 3 S2‑ ‑ 2 e‑ D S ¯ lg K = 16,5, 2 NO3‑+4H+ + 3e‑DNO +2H2O, lg K = 48,7
| |||||||
| 1.2.1 | Hg22+ | 3 моль/л HCl | Pбілий | Hg22+ + 2HCl- Hg2Cl2¯ ‑ lg Ks = 17,91 | ||||||
| 1.2.2 | Р1 | 3 моль/л NH3 | Рбілий ® чорний | Hg2Cl2 D Hg22+ + 2Cl- lg Ks = -17,9 2NH3 DNH32- + NH4+ Hg22+ + 2NH3 D HgNH2+ + NH4+ + Hg¯ Hg2Cl2 + 2NH3 D HgNH2Cl¯ + Hg¯ + NH4+ + Cl- | ||||||
| 1.2.3 | P1.2.1 | Br2 | Pбілий ® F | Hg2Cl2¯ DHg22+ + 2Cl lgKs = -17,91 Hg22+ - 2ē D2Hg2+ lgK1 = -30,7 Br2 + 2ē D 2Br- lgK2 = 18,3 ∙ 2 = 36,6 Hg22+ 2Cl- D Hg2Cl2 lgβ2 = 13,23 Hg2+ + 2Br- DHgBr2 lgβ2 = 23,82 Hg2Cl2¯ + Br2 D HgCl2 +HgBr2 lgK = -17,91 – 30,7 + 36,6 + 13,23 + 23,82= = 25,04 | ||||||
| 1.2.4 | Hg22+ Hg2+ | SnCl2 SnCl2 | Pбілий Рчорний | Hg22+ +2Cl- DHg2Cl2¯ -lgKs = 17,91 Hg2+ + 4Cl- DHgCl42- lgβ4 = 15,3 2HgCl42- + SnCl42- D Hg2Cl2¯ + SnCl62- +4Cl- Hg2Cl2¯ + SnCl42- D 2Hg¯ + SnCl62- | ||||||
| 1.2.5 | Hg22+ | H2S KJ | Pчорний Р жовтий | Hg22+ + S2- D HgS¯ + Hg¯ Hg22+ - 2ē D 2Hg2+ lgK1 = 30,7 Hg22+ + 2ē D2Hg¯ lgK2 = 26,8 Hg2+ + S2- D HgS -lgKs = 52,7 lgK=lgK1+lgK2–lgKs=30,7+26,8+52,7=48,8 Hg22+ + 2J- D HHg2J2¯ -lgKs = 28,33 Hg22+ + CrO42- DHg2CrO4¯ -lgKs = 8,7 | ||||||
| 1.3.1 | Pb2+ Р1.3.2 | 3 моль/л HCl H2O, нагрівання. | Pбілий Р® F | Pb2+ + 2Cl- D PbCl2¯ -lgKs = 4,87 PbCl2¯ D Pb2+ 2Cl- lgKs = -4,87 t підвищує розчинність | ||||||
| 1.3.2 | Pb2+ P1.3.2 | KJ H2O, нагрівання, охолодження | P Р®F | Pb2+ + 2J- D PbJ2¯ -lgKs = 8,10 PbJ2¯ D Pb2+ + 2J- -lgKs = -8,10 Спочатку кристали були великими, а після перекристалізації стали роздрібненими. | ||||||
| 1.3.3 | Pb2+ | 3 моль/л H2SO4 | Pбілий | Pb2+ SO4 D PbSO4¯ -lgKs = 7,79 | ||||||
| 1.3.4 | P1.3.3 | NaOH 6 моль/л, нагрівання | Р® F | PbSO4¯ D Pb2+ +SO42- lgKs = -7,79 Pb2+ + 3OH- D Pb(OH)3- lgβ3 = 13,93 PbSO4¯ + 3OH- D Pb(OH)3- + SO42- lgK = lgK3 + lgβ3 = -7,79 + 13,93 = 6,14 | ||||||
| 1.3.5 | P1.3.3 | HNO3 3 моль\л, нагрівання | Рбілий ® F | PbSO4¯ D Pb2+ + SO42- lgKs = -7,79 SO42- + H+ D HSO4 lgKH1 = 1,99 Pb2+ + NO3- D Pb(NO3)+ lgβ1 = 1,17 PbSO4¯ + H+ + NO3- D PbNO3+ + HSO4- lgK=lgKs+lgKH1+lgβ1 = -7,79+1,19+1,17 = = -4,63 | ||||||
| 1.3.6 | P1.3.3 | NH4Ac, нагрівання | P®F | PbSO4¯ D Pb2+ + SO42- lgKs = -7,79 NH4+ D NH3 + H+ -lgKH1 = -9,244 SO42- + H+ D HSO4- lgK’H1 = 1,99 Pb2+ + Ac- D PbAc+ lgβ1 = 2,68 PbSO4¯ + NH4+ + Ac- D PbAc+ + NH3 + + HSO4- lgK = lgKs + lgKH1 + lgK’H1 + lgβ1 = = - 7,79 – 9,244 + 1,99 + 2,68 = -12,364 | ||||||
| 1.3.7 | Pb2+ | K2CrO4 K2Cr2O7 | Pжовтий Pжовтий | Pb2+ + CrO42- D PbCrO4¯ -lgKs = 13,79 H2O + Cr2O42- D 2CrO42- + H+ -lgβH2 = -6,49 2Pb2+ + Cr2O72- + H2O D 2PbCrO4¯ + 2H+ lgK = -lgKs - lgβH2 = 13,79 – 6,49 = 7,3 | ||||||
| 1.3.8 | Pb2+ | Na2S | P чорний | Pb2+ + S2- D PbS¯ -lgKs = 27,5 | ||||||
| 2.1.1 | Ba2+ | 3 моль/л H2SO4 | P білий | Ba2+ + SO42- D BaSO4¯ -lgKs = 9,96 | ||||||
| 2.1.2 | Р2.1.1 | Na2CO3 нагрівання | P білий | BaSO4¯ + СO32- D BaCO3¯ + SO42- BaSO4¯ D Ba2+ + SO42- -lgKs = -9,96 Ba2+ + CO32- D BaCO3¯ -lgKs = -8,29 lgK = lgKs – lgKs = -9,96 + 8,29 = -1,67 | ||||||
| P2.1.2 | 3 моль\л HNO3 | P® F | BaCO3 D Ba2+ + CO32- lgKs = -8,29 Ba2+ + NO3- D BaNO3+ lgβ1 = 0,9 H+ + CO32- D HCO3- lgKH1 = 10,33 BaCO3 + NO3- + H+ D BaNO3+ + HCO3- lgK = lgβ1 + lgKH1 – lgKs = 0,9 + 10,33 – – 8,29 = 2,94 | |||||||
| 2.1.3 | Ba2+ Sr2+ | K2CrO4 K2Cr2O7 K2Cr2O7 + HAc | Pжовтий Ржовтий Ртемно-жовтий | Ba2+ + CrO42- D BaCrO4¯ -lgKs = 9,67 Cr2O42- + H2O D 2HCrO4 -lgKs =-1,53 2 HCrO4- D H+ + CrO42- -lgβH1 =-6,51 2 Sr2+ CrO42- D SrCrO4¯ -lgKs = 4,65 Cr2O72- + H2O + 2 Sr2+ D2H+ + 2SrCrO4 lgK = -lgKs – lgK – 2 lgβH1 – 2lgKs = = 9,67 – 1,53 – 2 ∙ 6,51 + 2 ∙ 4,65 = 4,42 | ||||||
| 2.1.4 | Ba2+ | Na2C6O6 |
 
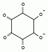 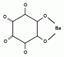
| |||||||
| P2.1.4 | 3 моль/л HCl | BaC6H6¯ + H+ D Ba2+ + HC6O6- | ||||||||
| 2.1.5 | Ba2+ | KMnO4 H2SO4 розб. NH2OH ∙ HCl | Утворюється тверда речовина | |||||||
| Sr2+ | KMnO4 H2SO4 розб. NH2OH ∙ HCl | Pбілий | Утворюється тверда речовина | |||||||
| 2.2.1 | Sr2+ | 3 моль/л H2SO4 | Pбілий | Sr2+ + SO42- D SrSO4¯ -lgKs = 6,5
| ||||||
| 2.2.2 | P2.2.1 | Na2CO3 | Pбілий Pбілий | SrSO4¯ D Sr2+ + SO42- lgKs = -6,5 Sr2+ + CO32- D SrCO3 + SO42- lgKs = 9,03 SrCO3¯ + CO32- D SrCO3¯ + SO42- lgK = lgKs – lgKs = -6,5 + 9,03 = 2,53 | ||||||
| P2.2.2 | 3 моль/л HNO3 | P® F | SrCO3¯ D Sr2+ + CO32- lgKs = -9,03 CO32+ + 2H+ D H2O + CO2↑ -lgβH2 = 16,68 SrCO3¯ + 2H+ D Sr2+ + H2O + CO2↑ lgK = lgKs + lgβH2 = -9,03 + 16,68 = 7,65 |
| 2.3.1 | Ca2+ | 3 моль/л H2SO4 | Pбілий | Сa2+ + SO42- CaSO4¯ -lgKs = 4,62 |
| pF2.3.1 | Sr(NO3)2 нагрівання | Pбілий | CaSO4¯ D Сa2+ + SO42- lgKs = -4,62 Sr2+ + SO42- D SrSO4¯ -lgKs = 6,5 Sr2+ + CaSO4 D SrSO4¯ + Ca2+ lgK = lgKs – lgKs = -4,62 + 6,5 = 1,88 | |
| pF2.3.1 | BaCl2 нагрівання | Pбілий | CaSO4 D Ca2+ + SO42- lgKs = -4,62 Ba2+ + SO42- D BaSO4¯ -lgKs = 9,96 Ba2+ + CaSO4¯ D BaSO4 + Ca2+ lgK = lgKs – lgKs = -4,62 + 9,96 = 5,34 | |
| 2.3.2 | Р2.3.1 | Na2CO3 | Pбілий | CaSO4 D Ca2+ + SO42- lgKs = -4,62 Ca2+ + CO32- D CaCO3¯ -lgKs = 8,52 CaSO4¯ + CO32- D CaCO3¯ + SO42- lgK = lgKs – lgKs = -4,62 + 8,52 = 3,9 |
| P2.3.2 | 3 моль/л HNO3 | P® F | CaCO3¯ D Ca2+ + CO32- lgKs = -8,52 CO32- + 2H+ D CO2↑ + H2O lgbH2 = 16,68 CaCO3¯+ 2H+ D Ca2+ + CO2↑ + H2O lgK = lgKs + lgbH2 = -8,52 + 16,48 = 8,16 | |
| 2.3.3 | Ca2+ | (NH4)2C2O4 | Pбілий | Ca2+ + C2O42- D CaC2O4¯ -lgKs = 7,9 |
| P2.3.3 | 3 моль/л HCl | P® F | CaC2O4¯ D Ca2+ C2O42- lgKs = -7,9 | |
| Sr2+ | (NH4)2C2O4 | Pбілий | Sr2+ + C2O42- D SrC2O4¯ | |
| Ba2+ | (NH4)2C2O4 | Pбілий | Ba2+ + C2O42- D BaC2O4¯ -lgKs = 6,0 | |
| BaC2O4 | 3 моль/л HCl | P® F | BaC2O4¯ D Ba2+ + C2O42- lgKs = -6,0 C2O42- + 2H+ D H2C2O4 lgbH2 = 5,52 BaC2O4 + 2H+ D Ba2+ + H2C2O4 lgK = lgKs + lgbH2 = -6,0 + 5,52 = -0,48 | |
| 2.3.4 | Ca2+ | K4Fe(CN)6, NH4Cl | Pбілий | Сa2+ + 2NH4+ + Fe(CN)64- D Ca(NH4)2 + Fe(CN)6¯ |
| Sr2+ | - | Осад утворюється тільки в І випадку | ||
| Ba2+ | - |
1.1.2. РозчиненняAgCl(s)у розчині з с(НСl) = 12 моль/л.До осаду, що здобутий у операції 1.1.1, додайте 10 крапель концентрованого розчину НСl (або насиченого розчину КСl). Перемішайте паличкою, відокремте на центрифузі. Чи зменшилась кількість осаду? Порівнюючи логарифми констант стійкості комплексів (або побудувавши КЛД із головною змінною рСl), визначте, який комплекс переважає при [Сl‑] = 12 моль/л.
Частину відокремленого розчину відберіть у пробірку й перемішайте з рівним об’ємом води. Поясніть спостереження зміщенням рівноваги, якщо розведення зменшить вдвічі концентрації як [AgCl32‑], так і [Cl‑]?
 1 AgCl(s) D Ag+ + Cl‑ lg Ks = ‑9,75,
1 AgCl(s) D Ag+ + Cl‑ lg Ks = ‑9,75,
1 Ag+ + 3 Cl‑D AgCl32‑, lg b3 = 6,0,
| AgCl(s) + 2 Cl | D | AgCl32‑, | lg Ks3 = lg Ks + lg b3 = ‑3,75. |
1.1.3. Розчинення AgCl(s) у розчині амоніаку, с(NН3) = 3 моль/л.До осаду, що здобутий у операції 1.1.1 (друга пробірка), додайте, перемішуючи, розчин NН3 до повного розчинення. Розділивши розчин на 2 пробірки, у першу з них додайте 3-5 крапель розчину з с(НNО3) = 3 моль/л, а у другу рівний об’єм розчину з с(КІ) = 0,5 моль/л.
Розрахуйте логарифми констант реакцій
AgCl(s) + 2 NH3 D Ag(NH3)2+ + Сl‑,
Ag(NH3)2+ + 2 H+ D AgCl(s) + 2 NH4+,
Ag(NH3)2+ + I‑ D AgI(s) + 2 NH3,
склавши відповідні лінійні комбінації реакцій із довідкової літератури. Чи пояснюють ці величини Ваші спостереження?
1.1.4. Забарвлені малорозчинні сполуки арґентуму.У 3 пробірки внесіть по 2 краплі розчину AgNО3. У 1-у додайте рівний об’єм розчину гідроксиду натрію, c(NaOH) = 6 моль/л, а у 2-у − розчину сульфіду натрію, c(Na2S) = 2 моль/л, а у 3-у − розчину хромату калію, с(К2СгО4) = 0,3 моль/л. Визначте кольори осаду й запишіть рівняння реакцій. Осади відокремте на центрифузі, промийте водою, i у кожну пробірку додайте по 2-3 краплі розчину з с(HNO3) = 3 моль/л. Перемішайте, визначте зміни. Якщо осад не розчиняється, підігрійте пробірку на водяній бані. Запишіть рівняння реакцій i знайдіть їх логарифми констант.
1.2. Меркурій(I), ртуть(I), Hg22+. Уci відходи меркурію (отрута!) слід збирати у спеціальну банку.
1.2.1. Осадження Hg2Cl2(s).Вмістіть у пробірку 3 краплі розчину iз c(Hg2(NO3)2) = 0,25 моль/л, додайте 3 краплі розчину з с(НСl) = 3 моль/л. Осад відокремити на центрифузі, промити двічі дистильованою водою i залишити для досліду 1.2.2.
1.2.2. Взаємодія Hg2Cl2(s) з аміаком. До осаду, що одержаний у досліді 1.2.1, додайте 3 краплі розчину з с(NH3) = 3 моль/л. При реакції
Hg2Cl2(s) + 2 NH3 D HgNH2Cl(s) + Hg(l)
утворюється осад інтенсивно чорного кольору, що переходить у сірий. Це пояснюють зміною розміру крапельок Hg(l) на фоні білого HgNH2Cl(s). Раніше зміни пояснювали утворенням i подальшим розкладом нестійкої гіпотетичної чорної сполуки Hg2NH2Cl(s), продукту меркурію (I).
1.2.3. Забарвлені малорозчинні продукти, утворені меркypiєм (I).У 4 окремих гніздах білої крапельної пластинки вмістити по 1 краплі розчину Hg2(NO3)2. У 1-е гніздо додайте 1 краплю розчину з c(NaOH) = 6 моль/л, у 2-е − розчин KI, у 3-є − розчин К2СrО4, у 4-у − розчин дифенілкарбазиду,
 . .
|
Відзначте колір осадів. Запишіть рівняння реакцій, зваживши, що у лужному середовищі меркурій (І) диспропорціонує на меркурій (0) та меркурій (ІІ).
1.3. Плюмбум (ІІ), свинець (ІІ),Рb2+.
1.3.1. Осадження РbСl2(s).Вмістіть у пробірку 5 крапель розчину з с(Рb(NO3)2) = 0,5 моль/л й додайте 5 крапель розчину з с(НСl) = 3 моль/л. Осад відокремте на центрифузі, додайте 25 крапель дистильованої води i нагрійте у киплячій водяній бані, періодично перемішуючи. Охолодіть. Відзначте зміни. Як температура впливає на розчинність? Для звичайної температури побудуйте КЛД із головною змінною рСl. Порівняйте теоретичну повноту осадження AgCl(s) та РbСl2(s).
1.3.2. Осадження PbI2(s).До 1-2 крапель розчину Рb(NO3)2 додайте 1‑2 краплі розчину KI. Відокремте осад на центрифузі, додайте декілька крапель дистильованої води та розчину оцтової кислоти, с(НАс) = 6 моль/л, нагрійте у киплячій водяній бані, періодично перемішуючи, поки осад не розчиниться. Piзко охолодіть, підставивши пробірку під струмінь води, i спостерігайте утворення блискучих золотавих кристалів.
Умови реакції: слабко кисле середовище (рН = 3-5), уникати значного надлишку KI, щоб Рb (II) не втрачати у аніонних іодокомплексах.
1.3.3. Осадження PbSO4(s). У 3 пробірки внесіть по 2 краплі розчину Рb(NO3)2, додайте по 2 краплі розчину з c(H2SO4) = 3 моль/л. Відокремте осад на центрифузі, двічі промийте дистильованою водою й залишіть для дослідів 1.3.4 та 1.3.5. Дослідіть за КЛД (головна змінна pSO4) вплив концентрації реактиву на повноту осадження.
1.3.4. Розчинність PbSO4(s)у лугах.До осаду, що одержаний у 1-й npoбipці досліду 1.3.3 додайте розчин iз c(NaOH) = 6 моль/л. Нагрійте на водяній бані, перемішуючи. Відзначте зміни. Розрахуйте логарифм константи ЗДМ реакції
PbSO4(s) + 3 ОН+ D Pb(ОН)3‑ + SO42‑.
1.3.5. Розчинність PbSO4(s) у азотній кислоті.До осаду у 2-й пpoбiрці досліду 1.3.3, додайте 10 крапель розчину із с(НNО3) = 3 моль/л. Нагрійте на водяній бані, перемішуючи. Чи змінилась кількість осаду? Розрахуйте логарифм константи ЗДМ реакції
PbSO4(s) + Н+ + NO3‑ D PbNО3+ + HSO4‑.
1.3.6. Розчинність PbSO4(s) у розчині ацетату амонію.До осаду, що одержаний у 3-й пробірці досліду 1.3.3, додайте 10 крапель насиченого розчину NH4Ac. Нагрійте на водяній бані, перемішуючи. Чи змінилась кількість осаду? Розрахуйте логарифм константи ЗДМ реакції
PbSO4(s) + Ас‑ D PbAc+ + SO42‑.
1.3.7. Осадження PbСгO4(s).У 2 окремих гнізда білої крапельної пластинки вмістіть по 1 краплі розчину Pb(NO3)2. У 1-е гніздо додайте 1 краплю розчину К2СгO4, а у 2-е – розчини К2Сг2О7 та ацетату натрію, NaAc. Упевніться, що осади однакові (умови осадження − нейтральне або слабко кисле середовище). Запишіть рівняння реакцій, розрахуйте їx логарифми констант ЗДМ, склавши у 2-му випадку відповідну лінійну комбінацію реакцій із довідкової літератури, де роль NaAc слабка аніонна основа,
H+ + Ас‑ D НАс,
що зміщує рівновагу
Сr2О72‑ + Н2О D 2 НСrO4‑.
Таблиця 6
Дата добавления: 2016-08-07; просмотров: 771;
