Розрахунки рН буферних розчинів.
Розглянемо кілька прикладів.
Приклад 1. Визначити рН буферного розчину, який приготували змішуванням розчинів: 55 мл оцтової килоти (с0(HAc) = 0,15 моль/л) та 120 мл розчину ацетату натрію (c0(NaAc) = 0,22 моль/л).
Розв’язання. Обчислимо загальні концентрації в розчині.
с(HAc) = c0(HAc)·V(HAc) / ( V(HAc) + V(naAc)) = 0,15·0,055/(0,055 + 0,120) = 0,0471 моль/л.
с(СН3COONa) = c0(NaAc)·V(NaAc) / ( V(HAc) + V(naAc)) = 0,22·0,120/(0,055 + 0,120) = 0,1509 моль/л.
Скористаємося схемою М. П. Комаря.
CH3COOH D CH3COO- + H+ lgKа = 4,76
с 0,0471 0,1509
Δс -х х х
[ ] 0,0471 − x 0,1509 + x x
Зробимо підстановку в рівняння константи ЗДМ
-lgх = pH = pKa +lg 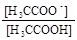 = 4,76 + lg
= 4,76 + lg 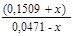 ;
;
Приймаючи умови 0,0471 >>x, 0,1509>>x маємо: рН = 5,27.
Умови справджуються 0,0471 >>10-5,27 0,1509>>10-5,27 . Значить розвязання вірне.
Відповідь. рН = 5,27.
Приклад 2. Визначити рН буферного розчину, який приготували змішуванням розчинів: 75 мл гідрокарбонату натрію (с0(NaHCO3) = 0,12 моль/л) та 60 мл розчину карбонату натрію (c0(Na2CO3) = 0,03 моль/л).
Розв’язання. У розчині співіснують іони HCO3- та СO32-. Ці два іони співіснують в другій ступінчастій рівновазі дисоціації вугільної кислоти:
HCO3- D СO32- + H+ рKа2 = 10,33;
с 0,12·0,0750,03·0,06
0,075+0,06 0,075+0,06
Δс -х х х
[ ] 0,12·0,075 - x 0,03·0,06 + x x
0,075+0,06 0,075+0,06
Приймаючи умови x << 0,12·0,075 та x<<0,03·0,06, виражаємо значення –lg x з константи рівноваги
 -lgх = pH = pKa2 + lg
-lgх = pH = pKa2 + lg 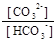 = 10,33 + lg
= 10,33 + lg 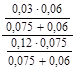 = 9,63.
= 9,63.
Відповідь. рН = 9,63.
Звертаємо увагу, що добуток концентрації на об’єм розчину можна замінити на кількість речовини (n). При цьому рН буферного розчину залежить від співвідношення кількостей речовини іонів, що утворюють буферну систему (nHA / nA-) і не залежить від об’єму розчину, в якому вони знаходяться. Саме тому розведення буферного розчину водою не змінює (значимо) його рН.
Дата добавления: 2016-08-07; просмотров: 1327;
