перименопаузального возраста 2 страница
5.3. Стратегия современной постменопаузальной терапии
5 мг ежедневно. Согласно данным литературы, удовлетворительного лечебного эффекта при использовании одного этого препарата удается достигнуть приблизительно в 1/3 наблюдений у пациенток после удаления придатков матки.
Действующим началом в препарате является норэтистерон; пик концентрации препарата в плазме крови достигается через 1—2 ч после приема. При оценке терапевтического эффекта необходимо учитывать, что в процессе биотрансформации в организме небольшое количество норэтистерона (0,15—0,6 % пероральной дозы) превращается в этинилэстрадиол. Противопоказаний к назначению норколута в постменопаузе практически нет, но при длительном его применении следует обратить внимание на предрасположенность пациенток к тромбоэмболическим осложнениям, печеночной дисфункции и др.
Имеется опыт применения хломадинона ацетата, который, согласно опубликованным в литературе данным, также дает благоприятные результаты терапии КС.
Для лечения больных с КС, протекающим на фоне гиперэстро-гении, установленной при кольпоцитологическом исследовании и морфологическом изучении соскоба эндометрия, рекомендуется применение линестренола (оргаметрил). Первые 3 дня препарат назначают по 3 таблетке (0,05 мг) 3 раза в день, в 4—5-й день — по 1 таблетке 3 раза в день, затем прием линестренола продолжают в дозе 0,05 мг в течение нескольких месяцев или даже до года. При этом у большинства больных полностью исчезают вегетативные и нервно-психические симптомы, восстанавливается работоспособность.
Необходимость длительного использования гормональных препаратов у женщин в пери- и постменопаузе ставит перед клиницистами ряд сложных вопросов. Среди них одно из первых мест по праву занимает вопрос о влиянии этих лекарственных средств на липидный спектр крови. В литературе приводятся данные о том, что разные группы гормональных препаратов оказывают неоднозначное действие на липидный спектр крови пациенток с КС в пре- и постменопаузе [14, 16]. Так, этинилэстрадиол повышает на 20—40 % содержание в крови липопротеидов высокой плотности (ЛПВП). Эстрадиола валерат оказывает менее выраженный эффект на липидный спектр крови, чем этинилэстрадиол.
В этой связи следует остановиться также и на вопросе о назначении ЗГТ больным с особой формой КС — климактерической
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
кардиопатией (миокардистрофией). При этой форме КС ЗГТ является методом выбора и способствует устранению не только приливов жара и других типичных проявлений заболевания, но и кардиал-гических симптомов. Этот эффект сопровождается у большинства больных положительной динамикой и даже нормализацией ЭКГ и наблюдается на фоне достоверного снижения уровней содержания ФСГ и ЛГ в плазме периферической крови. Располагая опытом применения различных поколений комбинированных эстроген-геста-генных соединений, авторы рекомендуют дифференцированный подход и индивидуализацию при выборе минимально-оптимальной дозы препарата в зависимости от степени выраженности эстроген-ного дефицита [5, 10].
Основные затруднения в повседневной клинической практике возникают в связи с необходимостью выбора адекватного лечебного воздействия при остеопорозе в рамках долгосрочной стратегии для преодоления возрастных метаболических нарушений в костной ткани как у женщин группы риска, так и, особенно, при уже развившихся проявлениях остеопороза или сердечно-сосудистых нарушений. Несмотря на неоднозначность приводимых в литературе данных, большинство исследователей единодушны в положительной оценке лечебного эффекта половых гормонов по отношению к костной ткани, особенно при назначении их в профилактических целях. На фоне ЗГТ эстрогенами существенно снижается степень риска и частота наступления переломов, однако эффект подобного воздействия связывается в большей степени с поддержанием, нежели восстановлением костной ткани [24].
При выборе гормонального препарата и схемы его назначения при остеопорозе с профилактической и/или лечебной целью следует руководствоваться такими параметрами, как:
• максимум (пик) массы костной ткани в возрасте 35 лет;
• степень потери ее в течение первых 3—6 лет после менопаузы;
• снижение темпа возрастных метаболических изменений и потери костной ткани в 65-летнем возрасте.
Эстрогены, как и кальцитонин, бисфосфонаты и большие дозы кальция, тормозят резорбцию костной ткани; стимулирующим влиянием на новообразование последней обладают гормон роста и паратиреоидный гормон.
К настоящему времени накоплен значительный опыт применения отдельных эстрогенных препаратов для лечения остеопороза.
5.3. Стратегия современной постменопаузальной терапии
Мы придерживаемся той точки зрения, что, по данным литературы, наибольшим клиническим эффектом (рис. 5.11) обладают препараты конъюгированных эстрогенов. Их назначают длительно в клиническом режиме по 4—5 дней с 2—3-дневным перерывом в дозе 0,625—1,25 мг/сут. В зависимости от исходного уровня эстрогенов каждые 2—3 месяца в течение 6—8 дней больным назначают геста-генные препараты (норэтистерон, МПА).
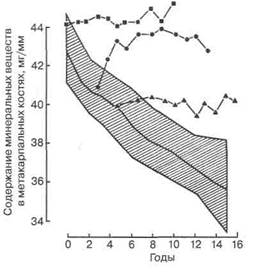
|
Рис. 5.11. Влияние времени начала лечения препаратами конъюгированных эстрогенов после кастрации (сразу — квадратики; спустя 3 года — кружки; спустя 6 лет — треугольники) в сравнении с плацебо (заштрихованная часть рисунка) на потерю костной ткани (по [26])
Согласно данным более ранних исследований, необходимая суточная доза этинилэстрадиола для предупреждения остеопороза после хирургического выключения функции яичников у женщин моложе 45 лет составляет 20 мкг. Показано, что удаление яичников у женщин старше 45 лет, уже вступивших в перименопаузальный период, не увеличивает риска развития болезни. Следует учитывать, что клинический эффект эстрогенных препаратов у женщин с удаленными яичниками выше, чем у женщин аналогичного возраста при спонтанной менопаузе. Важно время начала приема гормональных препаратов после удаления яичников, что хорошо иллюстрирует рис. 5.12. С введением в клиническую практику комбинированных эстроген-гестагенных двух- и трехфазных препаратов существенно расширились возможности лечебно-профилактического воздействия при остеопорозе.
| Глава 5. Патология репродуктивной системы в переходном и старческом возрасте |
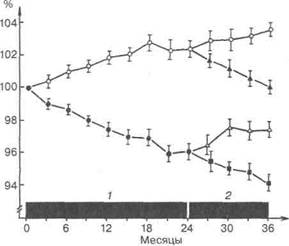
Рис. 5.12.Уровень минерализации костной ткани во время лечения
препаратом трисеквенс (светлые значки) и плацебо (темные значки)
до менопаузы (1) и после нее (2) (по [24])
Механизм терапевтического эффекта эстрогенов при остеопо-розе до настоящего времени не выяснен полностью. Высказывается предположение, что под воздействием длительного приема эстрогенов тормозится процесс резорбции костной ткани и это сопровождается снижением перехода кальция из костной ткани в кровь. В этих условиях, по-видимому, включаются гомеостатические механизмы, повышается уровень секреции паратгормона и активизируется образование биологически активного метаболита витамина D3. Однако обнаружить восстановление пременопаузального уровня кальция даже после 10-летнего приема препаратов эстрогенных гормонов не удалось. Относительно комбинированных эстроген-гестагенных препаратов различных поколений из-за отсутствия проспективных наблюдений сделать окончательные выводы пока невозможно.
Вместе с тем в этом направлении препаратом выбора вместо традиционной ЗГТ может служить гонадомиметический стероидный препарат ливиал (Л), являющийся производным 19-норте-стостерона и близкий по химической структуре норэтинодрелу и норэтистерону. Л оказывает слабые прогестагенный, эстрогенный и андрогенный эффекты и в организме быстро превращается в три
5.3. Стратегия современной постменопаузальной терапии
основных метаболита — ЗаОН, ЗвОН и 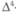 -изомер, обладающие селективными свойствами по отношению к органам-мишеням. В эксперименте показано, что
-изомер, обладающие селективными свойствами по отношению к органам-мишеням. В эксперименте показано, что  -изомер связывает и активирует ПР и АР, тогда как ЗаОН и ЗвОН метаболиты — ЭР. Метаболический эффект Л у женщин в постменопаузальном периоде характеризуется проявлением эстрогенных влияний на костную ткань и ткани стенки влагалища, прогестагенного влияния на ткань эндометрия и, напротив, андрогенного эффекта по отношению к мозгу и печени. В ткани молочных желез Л интенсивно подавляет активность суль-фатазы и в слабой степени активность 17в-ОСД, что проявляется блокированием превращения сульфата Э1 в Э2.
-изомер связывает и активирует ПР и АР, тогда как ЗаОН и ЗвОН метаболиты — ЭР. Метаболический эффект Л у женщин в постменопаузальном периоде характеризуется проявлением эстрогенных влияний на костную ткань и ткани стенки влагалища, прогестагенного влияния на ткань эндометрия и, напротив, андрогенного эффекта по отношению к мозгу и печени. В ткани молочных желез Л интенсивно подавляет активность суль-фатазы и в слабой степени активность 17в-ОСД, что проявляется блокированием превращения сульфата Э1 в Э2.
Фармакодинамические эффекты и клинический профиль Л характеризуются, в частности, тем, что в дозе 2,5 мг/день препарат способствует снижению секреции гонадотропинов у женщин постменопаузального возраста до пременопаузального уровня при отсутствии выраженного стимулирующего воздействия на эндометрий, предотвращает постменопаузальную потерю костной ткани и эффективно облегчает вазомоторные симптомы [2, 14]. Суточная лечебная доза препарата подобрана экспериментально соответственно дозо-зависимому эффекту. При ежедневном приеме Л облегчение приливов жара и потливости отмечается у 60,9 и 64,7 % женщин и, соответственно, в 2 раза чаще в сравнении с группой плацебо (30 %). Установлено благоприятное влияние на настроение и либидо. На этом фоне появление кровяных выделений из половых путей отмечено в 12 % в основной и в 6 % наблюдений в группе плацебо.
При приеме Л развитие побочных эффектов встречается редко. Изучение безопасности в течение 5-летнего срока наблюдения не выявило отрицательного влияния на функцию печени, обмен глюкозы; высказано также предположение о возможном повышении чувствительности периферических тканей к инсулину. Есть мнение, что положительное влияние Л на липидный обмен может служить для постменопаузальных женщин с инсулинзависимым диабетом защитой от заболеваний коронарных сосудов. Согласно данным литературы, наряду с воздействием на уровень гонадотропных гормонов, достижение фармакодинамического эффекта по отношению к приливам жара, изменениям поведения и настроения и другим проявлениям КС определяется воздействием на секрецию в-эндорфина и Р-липотропина в передней доле гипофиза. Существенное возрастание уровня содержания этих пептидов в плазме периферической
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
крови отмечается со 2-го месяца приема Л, а либидо — на 3-м месяце лечения, причем эти эффекты сохраняются до конца лечения. В целом же клинический эффект Л проявляется заметно выше по отношению к таким симптомам, как приливы жара и потливость, и выражен в меньшей степени при бессоннице, возбудимости, психической неуравновешенности и утомляемости. Отмеченные особенности фармакодинамического эффекта Л идентичны у женщин с естественной и искусственной менопаузой, причем у 95 % женщин в периоде постменопаузы поддерживается атрофическое состояние эндометрия.
В связи с нередким назначением Л в виде длительного монотерапевтического воздействия вопрос о риске возникновения кровяных выделений из половых путей приобретает особое значение. По данным литературы, на фоне приема Л появление кровяных выделений отмечено у женщин относительно более молодого возраста — 47,9 ± 5,52 лет (SD) в сравнении с теми, у кого они не возникали (51,2 ± 3,35 года; р < 0,05), при меньшем интервале времени после менопаузы, а также при более высоком уровне содержания 17|3-эстрадиола в плазме периферической крови. Так, более высокий уровень содержания 17[3-эстрадиола в плазме периферической крови был отмечен у 67 % женщин с возникшими кровяными выделениями и только у 11 % при их отсутствии (р < 0,001), причем указанные закономерности относились к контингенту женщин, начавших прием Л в пределах первых 3-х лет после менопаузы.
О достоинствах проведения ЗГТ ливиалом свидетельствуют также данные наблюдений о благоприятном клиническом эффекте препарата у женщин постменопаузального возраста с бессимптомной ЛМ в виде краткосрочных и/или более продолжительных курсов лечения, что, как правило, не сопровождается увеличением размеров узлов опухоли. Положительный результат отмечен также у больных климактерической миокардиодистрофией.
В контексте долгосрочной стратегии при ЗГТ особое значение приобретают особенности воздействия Л на минеральный состав костной ткани в связи с выраженной антирезорбтивной и анаболической активностью препарата. В ходе 2-летнего плацебоконтро-лируемого исследования у женщин с остеопорозом было отчетливо показано увеличение массы костной ткани: через 8 мес. — на 4%, через 24 мес. — на 8 % (р < 0,001), тогда как в наблюдавшейся параллельно группе контроля ежегодная ее потеря составляла 2%.
5.3. Стратегия современной постменопаузальной терапии
В систематическом обзоре рандомизированных исследований, опубликованных в течение 20-летнего периода времени (1981—2001), приводятся результаты изучения влияния ежедневного приема 2,5 мг Л в ранние и поздние сроки постменопаузального периода на МПКТ в поясничном отделе позвоночника [36]. Согласно приводимым данным, применение Л у практически здоровых женщин в раннем пост-менопаузальном периоде способствует повышению МПКТ на 15 %, а в поздние сроки — предотвращает потерю МПКТ в сравнении с плацебо. Выраженный клинический эффект отмечен у женщин, леченных целенаправленно по поводу остеопороза. После применения Л в течение 2 лет отмечено повышение МПКТ в поясничной области на 12 %, более длительно — еще на 5 %.
Таким образом, в целом, по данным систематического обзора, к числу убедительных данных о положительном клиническом эффекте Л относятся снижение и облегчение приливов жара, потливости и повышение МПКТ, особенно у страдающих остеопорозом женщин.
Рассмотрение дискуссионных аспектов долгосрочной стратегии ЗГТ требует пристального внимания к столь важному направлению, как риск развития рака молочной железы. Накопленный опыт свидетельствует об отсутствии возрастания частоты развития рака молочной железы при 5-летней ЗГТ ливиалом при возрастании на 30-50% при продолжении ЗГТ до 10—15 лет вне связи с пред-существовавшими факторами риска и использованием защитного эффекта прогестагенов. Вопрос же о назначении Л больным с менопаузальным синдромом при доброкачественных заболеваниях молочных желез, так же как и женщинам в отдаленные сроки после оперативного вмешательства по поводу рака молочной железы, остается дискуссионным и требует дальнейшего изучения и обсуждения. Вместе с тем, в соответствии с результатами экспериментальных исследований, заслуживают внимания данные о том, что Л способствует снижению степени клеточной пролиферации в ткани молочных желез, повышению активности 17в-ОСД (как своеобразного маркера клеточной дифференциации) и усилению апоптоза как в норме, так и при злокачественном процессе. Упоминание об этих данных может свидетельствовать об антиэстрогенных свойствах Л, проявляющихся, в частности, по отношению к эпителиальному компоненту ткани молочных желез.
Таким образом, анализ накопленных к настоящему времени клинических и экспериментальных данных о фармакодинамическом и
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
клиническом профиле Л подтверждает своеобразную тканевую его специфичность, благодаря которой в организме пациенток происходит своеобразная имитация эндокринной функции яичников. В связи с этим имеются основания полагать, что при определенных условиях препарат может занять должное место в качестве альтернативы ЗГТ, назначаемой с профилактической и лечебной целью при некоторых системных нарушениях у женщин постменопаузального возраста, особенно в отдаленные после менопаузы сроки. Вопрос же об оптимальных сроках назначения и продолжительности подобной стратегии нуждается в дальнейшем изучении и уточнении, в том числе и с позиций доказательной медицины.
Селективные модуляторы эстрогенных рецепторов. Среди препаратов этого ряда достаточно широкое распространение в клинической практике предшествующих лет для профилактики и лечения рака молочной железы получил тамоксифен. Следующим препаратом из этого класса соединений явился ралоксифен, который применяется во многих странах для лечения и предупреждения остеопо-роза. По химической структуре ралоксифен является нестероидным бензотиофеном и в проведенных на крысах экспериментальных исследованиях проявил свойство снижать частоту развития и про-грессирование роста индуцированных эстрогенположительных опухолей молочной железы. Этот препарат также принято относить к категории селективных эстрогенных модуляторов на основе исследований, в которых была продемонстрирована его способность предупреждать возрастную потерю массы костной ткани и снижать концентрацию холестерола при отсутствии отрицательного влияния на состояние эндометрия. Естественно, что выбор данного препарата для лечения больных остеопорозом требует досконального изучения его свойств не только по отношению к способности ремоде-лировать костную ткань, но также применительно к соотношениям между пользой и риском по отношению к разнообразным системным эффектам. Данная категория вопросов особенно важна при выборе препарата, предназначаемого для длительного лечебного воздействия у женщин старше 60 лет, которые, кроме наличия осте-опороза, относятся к группам высокого риска сердечно-сосудистых патологий и онкологического риска.
В этом отношении к настоящему времени имеется возможность руководствоваться опубликованными в 2002 г. результатами 4-летнего сравнительного изучения двух доз ралоксифена (60 и 120 мг/сут),
5.3. Стратегия современной постменопаузальной терапии
выполненного в рамках многоцентрового рандомизированного слепого плацебоконтролируемого исследования, предназначенного для изучения системных его эффектов [25]. В этом исследовании участвовало 7705 женщин с продолжительностью постменопаузы > 2 лет, страдавшие верифицированным остеопорозом по шкале МПКТ < 2,5 или перенесшие рентгенологически документированные костные переломы. В процессе наблюдения на фоне лечения проводилась рентгеноабсорбциометрия в области поясничных позвонков и шейки бедра и исследовались биохимические маркеры ремоделирования костной ткани.
Результаты исследования продемонстрировали, что прием ра-локсифена существенно снижает риск возникновения повторных переломов позвонков при приеме 60 (ОР 0,64; 95 % ДИ 0,53—0,76) и 120 мг/сут (ОР 0,57; 95 % ДИ 0,48-0,69), но не переломы другой локализации. Динамика этих изменений свидетельствует о снижении частоты переломов позвонков на протяжении 3—4 лет наблюдения на 39 %. Частота же костных переломов другой локализации за этот период времени не изменилась и составила 11,5 % в группе плацебо и 10,7 % среди получавших ралоксифен. Среди последних были переломы кисти (4,2 и 3,5 % в зависимости от дозы препарата), голени (1,1 и 1,1 %) и бедра (1,1 и 1,1 %). На этом фоне существенно снизилось, по данным медианы, содержание в плазме периферической крови остеокальцина (в 3,5—4 раза в группе ралоксифена в сравнении с плацебо), костного изофермента щелочной фосфатазы (в 1,8 раза) и уровня выделения с мочой проколлагеновых пропеп-тидов (в 4 раза).
При отсутствии существенных различий между использованными дозами со стороны приведенных выше клинических эффектов общие тенденции со стороны побочных системных эффектов оказались неоднозначными. Так, более высокая частота осложнений (в сравнении с плацебо) касалась выявления таких эффектов обеих доз, как судороги в ногах, периферические отеки, диабет. Частота возникновения приливов жара существенно возрастала у пациенток, получавших ралоксифен в дозе 120 мг/сут. Более низкая частота осложнений была отмечена по отношению к гипертензии и гиперхолестеринемии. Спектр побочных эффектов соответствовал таковым при применении других селективных модуляторов, в частности тамоксифена. Среди них особого внимания заслуживают случаи тромбоза глубоких вен (ОР 2,76; 95% ДИ 1,3-5,86), легочной
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
эмболии (ОР 2,76; 95 % ДИ 0,95-8,1)) и тромбоза вен сетчатки глаза (ОР 0,50; 95 % ДИ 0,15—1,73). Рак эндометрия встретился с равной частотой в группе плацебо (0,3 %) и ралоксифена (0,2 %), тогда как рак молочной железы существенно реже — в1,7и0,6% соответственно при высокой вероятности различий (р < 0,001). Таким образом, основным итогом 4-летнего наблюдения явилось, что ралокси-фен существенно снижает риск переломов позвонков у страдающих остеопорозом женщин постменопаузального возраста и наряду с этим способствует снижению риска рака молочной железы.
В более ранних публикациях той же группы авторов сообщалось о результатах 2- и 3-летнего мониторинга эффекта от ежедневного применения ралоксифена в различных дозах от 30 до 150 мг женщинами 45—60 лет также в рамках многоцентровых исследований с использованием тех же биохимических маркеров ремоделирования костной ткани. При этом было показано, что ралоксифен снижает уровень содержания фибриногена, С-реактивного белка и антитромбина III, но оказывает отрицательное воздействие на противо-свертывающий потенциал периферической крови по показателю такого маркера антифибринолиза, как прокарбоксипептидаза U. В серии сравнительных исследований с комбинированной ЗГТ не было отмечено отрицательного влияния использованных режимов на биоэлектрическую активность сердечной мышцы и систолическую функцию левого желудочка.
К числу основополагающих работ в пользу выбора ралоксифена для определенных популяций пациенток в постменопаузе следует отнести фундаментальное исследование, проведенное на протяжении 12 мес. и посвященное изучению влияния на эндометрий эстрогенов и прогестинов в сравнении с ралоксифеном [38]. В этом исследовании, в которое было вовлечено 1109 женщин, ралоксифен был использован в стандартной дозе 60 мг/сут, эстрогены в виде 17(3-эстрадиола по 2 мг + 1 мг норэтистерона ацетата ежедневно. Критериями включения женщин в данное проспективное рандомизированное двойное слепое исследование служили отсутствие типичных вегетоневротических симптомов, наличие остеопороза или факторов риска сердечно-сосудистых заболеваний, толщина эндометрия менее 5 мм. Для основной части женщин исследование было запланировано на 6 мес, но для 347 из их числа оно было продолжено и на следующие 6 мес. Результаты мониторинга оценивались на основе клинических данных, по показателям УЗИ и гисто-
5.3. Стратегия современной постменопаузальной терапии
логического исследования эндометрия 4 независимыми экспертами. Согласно полученным результатам, среди пациенток, получавших ЗГТ эстрогенами и прогестинами, была обнаружена значительно большая частота доброкачественных изменений эндометрия в сравнении с получавшими ралоксифен — пролиферативньгх изменений эндометрия (8,8 % против 1,2 %), полипов эндометрия (4,3 % против 2,0%), кистозной его атрофии (5,5% против 1,2%); р < 0,04-0,001. Авторы данного исследования пришли к заключению о необходимости более пристального мониторинга состояния эндометрия у женщин, получающих ЗГТ в виде монотерапии эстрогенами и прогестинами, в сравнении с ралоксифеном, что имеет важное значение для выбора адекватной терапии для женщин с риском остеопороза в постменопаузальном возрасте. При выборе препарата следует также принимать во внимание отсутствие отрицательного влияния ралок-сифена на когнитивную функцию женщин постменопаузального возраста.
Альтернативные методы (фитоэстрогены). Повседневная клиническая практика показывает, что число пациенток пери- и постменопаузального возраста, начинающих пользоваться препаратами ЗГТ, к числу которых в развитых странах относится от 30 до 40%, не всегда сохраняется в течение достаточно продолжительного периода времени и в конечном итоге снижается до < 10-15 % и даже более. Потребность в поиске альтернативных методов лечебного воздействия обусловлена также и тем, что у лиц, перенесших или получающих адъювантную терапию по поводу злокачественных новообразований гормонозависимых органов (рака молочной железы), течение постменопаузального периода сопровождается особенно тяжелыми последствиями и прежде всего тяжелыми вегетоневроти-ческими нарушениями. К числу подобных альтернативных методов постменопаузальной терапии относится использование пищевых добавок, препаратов растительного происхождения и различных растений. Входящие в состав этих веществ компоненты обладают эстрогеноподобным биологическим эффектом, вследствие чего они получили название фитоэстрогенов (ФЭ). Одним из импульсов для развития альтернативной медицины явились результаты сравнительных эпидемиологических исследований, свидетельствующих о более низкой частоте распространения сердечно-сосудистых и онкологических заболеваний в странах южно-азиатского региона в сравнении с США.
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
ФЭ представляют собой семейство соединений растительного происхождения, которые обладают и эстрогенной, и антиэстроген-ной биологической активностью, продукты метаболических превращений которых обнаруживаются в различных биологических жидкостях организма млекопитающих, в том числе и человека. К числу наиболее распространенных ФЭ относятся изофлавоны, лигнаны и, в несколько меньшей степени, куместаны. ФЭ имеют 2-фенилнаф-таленовый тип химической структуры, аналогичный таковой для эстрогенов, и обладают сродством к ЭР, но слабой эстрогенной активностью. Антиэстрогенная активность ФЭ частично обусловлена их конкурирующей с эндогенными эстрогенами способностью по отношению к ЭР. Многие из потенциальных эффектов ФЭ обусловлены воздействием на энзимы, синтез белка, клеточную пролиферацию, ангиогенез, транспорт кальция, ростовые факторы, окисление липидов, клеточную дифференциацию и др. В ЖКТ человека продукты, содержащие лигнаны и изофлавоны, подвергаются сложным метаболическим превращениям, приводящим к образованию гетероциклических фенолов (близких эстрогенам по химической структуре). Метаболиты ФЭ поступают во внутрипеченочный круг кровообращения и выделяются с желчью, подвергаются деконъю-гации кишечной флорой, реабсорбируются, вновь связываются в печени и выделяются с мочой. В результате лигнаны и изофлавоны могут быть определены в различных биологических жидкостях организма — в моче, плазме, фекалиях, семенной жидкости, желчи, слюне и грудном молоке.
Метаболические превращения диетических ФЭ в значительной степени зависят от состава кишечной флоры, применения антибиотиков, заболеваний ЖКТ, а также связаны с особенностями «конкурентного» пищевого режима, богатого волокнами, овощами, фруктами, и длительностью его использования. Судя по приводимым в литературе данным, уровень содержания ФЭ в разных диетических режимах и, соответственно, биологический их эффект существенно отличаются в различных популяциях и зависят от сезонных, генетических и других свойств поглощаемых растений, способов приготовления пищи, а также от приверженности населения тем или иным религиозным традициям. Известно, например, что суточное потребление изофлавонов жителями Японии, Тайваня и Кореи колеблется от 20 до 150 мг. Биологические свойства ФЭ определяются их биодоступностью, которая, по данным исследования антиоксидантной
5.3. Стратегия современной постменопаузальной терапии
активности, возрастает после питья чая, красного вина, яблочного сока или приема черного изюма. Биодоступность катехинов зеленого чая в виде экстракта обеспечивает максимальную концентрацию полифенола в сравнении с красным вином, соевым молоком и соком грейпфрута [40]. Способ приготовления пищи оказывает существенное влияние на содержание в ней флавоноидов.
Постепенное накопление сведений, полученных в результате молекулярно-биологических исследований, экспериментов на животных и, ограниченно, в рамках клинических наблюдений, дает основание полагать, что ФЭ обладают потенциальными возможностями улучшать состояние сердечно-сосудистой системы, снижать заболеваемость раком, остеопорозом и облегчать менопаузальные симптомы. Эти наблюдения согласуются с данными эпидемиологических исследований, подтверждающих о более низкой частоте упомянутых заболеваний в популяциях, которые пользуются преимущественно растительной диетой, особенно при традиционно высоком содержании соевых продуктов.
Исследования, проведенные у женщин старших возрастных групп, свидетельствуют о выраженном гормональном воздействии, особенно при длительном использовании диетических режимов, содержащих ФЭ.
Приведенные данные объясняют все возрастающий интерес к данному классу соединений применительно к проблемам, связанным с постменопаузальным периодом в жизни женщины и со стремлением ограничить определенными рамками использование традиционной гормональной терапии. Вместе с тем необходимо избегать упрощенного подхода к данной проблеме и пытаться схематически экстраполировать диетические режимы и образ жизни лиц, проживающих в различных климатогеографических зонах и придерживающихся различных традиций, на другие регионы мира. Этот тезис не исключает, однако, привлечения внимания врачей при консультировании ими приближающихся и/или проходящих через мено- и постменопаузу женщин на особенности образа жизни, которые могут способствовать более благоприятному перешагиванию их через ступени возрастной лестницы. Основные аспекты этого «восхождения» касаются вегетоневротических нарушений, состояния сердечно-сосудистой системы, остеопороза и гормонозависимых заболеваний.
Дата добавления: 2016-07-09; просмотров: 669;
