перименопаузального возраста 1 страница
| Данные опроса и обследования пациентки | Баллы | ||
| + | - | ||
| Возраст/время, годы Применопаузе: 47-53 >54 <46 | 2 4 | ||
| После менопаузы: <2 3-5 >5 | |||
| Состояние костной системы Семейный анамнез Курение Ожирение Истощение | 2 2 | ||
| Сердечно-сосудистые заболевания Семейный анамнез Гипертензия Гиперлипидемия | 2 2 2 | ||
| Рак молочной железы 1 родственница < 60 лет 1 родственница > 60 лет > 2 родственниц Гистерэктомия: Да Нет | 0 0 | 6 6 | |
| Всего |
При выраженных симптомах постменопаузального синдрома алгоритм обследования включает систему последовательного обсуждения необходимых вопросов, связанных с характеристикой
 Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
клинических проявлений, выявлением преимуществ ЗГТ, оценкой факторов риска, отношения к этому методу профилактики и/или лечения самой пациентки. В ходе обсуждения принимаются также во внимание репродуктивный анамнез и статус к моменту обследования и определяется спектр необходимых дополнительных диагностических мероприятий.
Непосредственными показаниями к ЗГТ служат:
• вегетоневротические нарушения (приливы жара, ночные поты, депрессия, нарушения сна);
• урогенитальные нарушения (диспареуния, сухость во влагалище, учащенное мочеиспускание, дизурия, недержание мочи);
• системные нарушения (остеопороз, ИБС).
Абсолютными противопоказаниями для проведения ЗГТ явля
ются:
• рак молочной железы;
• рак эндометрия;
• коагулопатии;
• нарушения функции печени;
• тромбофлебит;
• маточное кровотечение неуточненного генеза.
Учитывая сложное переплетение патобиологии возрастных системных изменений в организме женщины и нередкую неоднозначность принимаемых решений, мы сочли целесообразным отойти от традиционного описания лечебных мероприятий и ЗГТ применительно к каждому из конкретных осложнений постменопаузально-го периода в отдельности и представить эту проблему комплексно, предоставив врачу самостоятельное решение относительно рационального выбора оптимальной стратегии и методов воздействия. Соответственно этому ниже изложены общие принципы ведения женщин с интактной маткой в пери- и постменопаузальном возрасте, возможности использования современной ЗГТ, селективных модуляторов эстрогенных рецепторов, альтернативных и различных других методов воздействия.
К настоящему времени достаточно четко сформулирована концепция о кратко- и долгосрочной стратегии ЗГТ, не подлежит сомнению постулат о необходимости реализации защитного эффекта прогестагенов по отношению к эндометрию, выявлены нюансы клинического профиля и фармакодинамического эффекта проге-
5.3. Стратегия современной постменопаузальной терапии
стинов (производных прогестеронового и норстероидного ряда). Можно также считать установленными альтернативы лечения ранних проявлений менопаузального синдрома путем назначения комбинированных эстроген-гестагенных препаратов в циклическом и (в более старшем возрасте) монотонном режимах у практически здоровых женщин [27, 29]. Особое место среди популяции женщин постменопаузального возраста, у которых выявлены несомненные показания к ЗГТ, занимает когорта женщин с преждевременной (до 40 лет) идиопатической или хирургической менопаузой в связи с повышением у них риска инфаркта миокарда в 4—5 раз в сравнении с практически здоровыми женщинами аналогичного возраста, т.е. в возрастной группе, в которой ИБС встречается редко [20]. Если же принять во внимание, что порог возникновения костных переломов у женщин группы риска достигается через 10—15 лет после прекращения функции яичников, то становится очевидным, что для женщин с преждевременной менопаузой этот период наступает уже в 6-м десятилетии жизни.
В процессе первоначального консультирования пациентка должна быть ориентирована врачом в отношении оптимальной продолжительности основного курса постменопаузальной ЗГТ.
В рамках кратковременной и средней продолжительности стратегии для устранения симптомов лечение проводится на протяжении 2—3 лет с постепенным выходом из лечебной программы при условии обратного развития симптомов. При их возобновлении после отмены ЗГТ лечение продолжают до окончательного достижения благоприятных результатов и устранения симптомов. При желании пациентки продолжать лечение после устранения симптомов при достижении хорошего самочувствия и/или в связи с семейным риском остеопороза и сердечно-сосудистых заболеваний при адекватном мониторинге и благоприятных обстоятельствах ЗГТ может быть продолжена в аналогичном режиме до 3-5 лет, после чего необходим пересмотр стратегии. Долговременная стратегия предусматривает принятие первоначального решения о продолжительности лечебного воздействия не менее 5 и, в отдельных случаях, до 10 лет [2, 42]. Прекращение лечения возможно на фоне любого режима при условии постепенного снижения дозы эстрогенного компонента на протяжении нескольких месяцев или, наоборот, повышения на этом фоне дозы прогестагенов.
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
При выборе режима ЗГТ серьезное внимание уделяется выбору химической структуры и эстрогенного, и гестагенного компонента. Наряду с этим важную роль играет определение дозового режима эстрогенного компонента. При выборе дозы желательно обеспечение пременопаузального уровня эстрогенов в плазме периферической крови, при котором достигается значительное облегчение или полное устранение симптомов и одновременно реализуется защитный эффект по отношению к костной ткани. Однако дозовый режим, обеспечивающий облегчение вегетоневротических симптомов, от остеопороза как такового не защищает. Суточные дозы 17(3-эстра-диола или эстрадиола валерата при пероральном применении обычно составляют 1—4 мг; аналогичный клинический эффект при оральном приеме конъюгированных эстрогенов достигается при назначении дозы 0,625 мг; доза 17(3-эстрадиола при чрескожном введении — 0,025—0,50 мг/сут. После 60-летнего возраста суточная доза эстрогенов должна быть снижена в значительной степени в сравнении с предшествующим десятилетием жизни. Чрескожный путь введения предпочтителен при необходимости минимизации воздействия вводимых гормонов на функцию печени. Непременное сочетание эстрогенного компонента с прогестагенным может быть осуществлено в циклическом или непрерывном режиме.
Эволюция представлений о гормональном лечении и гормональных препаратах, применяемых с лечебной и профилактической целью в пери- и постменопаузе, характеризуется значительным динамизмом. Возможности обсуждения подобных вопросов расширились после введения в клиническую практику препаратов натуральных и синтетических эстрогенов с разнообразным и широким спектром фармакологической активности. Прежде всего, это препараты, содержащие называемые классические эстрогены. К ним относятся препараты Э2 и его производных (эстрадиола дипропионат, эстрадиола валерат, эстрадиола бензоат, этинилэстрадиол, местранол и т.д.), препараты Э1 и его производных (фолликулин, стабилизированный мононатриевый сульфат Э1 и т.д.), а также Э3 (эстриол, овестин) и его производные, в том числе эстриола сукцинат (синапаузе). Особую группу представляют препараты конъюгированных эстрогенов, являющихся метаболитами эстрогенов преимущественно плацентарного происхождения. Это препараты эстрогенов из натуральных источников (моча жеребых кобыл) — премарин, пресомен, а также полученный синтетическим путем генезис. В состав премарина
5.3. Стратегия современной постменопаузальной терапии
входят Э1 (50—60%), эквилин и 17а-дигидроэквилин (до 30%) и в небольших количествах 17в-эстрадиол (5—15%).
Биологические свойства отдельных эстрогенов тоже различны. Так, Э2 способен оказывать в органах-мишенях пролиферативный эффект. Э3 присуще антиэстрогенное действие на гормонозависи-мые структуры эндометрия и молочных желез; в результате при длительном его применении не только не происходит стимуляции пролиферативных изменений в эндометрии, но наблюдается даже угнетающее влияние на гиперпластические процессы, что обусловлено конкурентными отношениями Э2 и Э3 за внутриклеточные рецепторы. Э3 свойствен выраженный кольпотропный эффект. В отношении Э1 высказывается предположение о возможном карцино-генном его эффекте.
Высокий лечебный эффект эстрогенов при КС представляет собой результат ЗГТ. У больных исчезают приливы жара, плохое самочувствие, улучшается состояние психики. При выборе гормональных препаратов для лечения КС следует учитывать возможность появления нежелательных побочных влияний: нагрубание молочных желез, гиперсекреция шеечной слизи, прибавка массы тела, тяжесть и судороги в ногах, нарушения со стороны ЖКТ. Имеется риск появления аллергических реакций, маточного кровотечения. Тщательного наблюдения и соблюдения большой осторожности при выборе метода гормонального лечения заслуживают больные диабетом, гипертонической болезнью, страдающие гиперлипиде-мией. Абсолютными противопоказаниями к применению эстрогенов служат тяжелые заболевания печени, энзимопатии, порфирия, тромбоэмболические заболевания, нарушения мозгового кровообращения, указания в анамнезе на рак матки, молочных желез и рак экстрагенитальной локализации, фиброзно-кистозная мастопатия; относительными — наличие миомы матки, эндометриоза, сердечно-сосудистой недостаточности с отечным синдромом. Лечение эстрогенами требует систематического обследования молочных желез (каждые 6 месяцев) и эндометрия (каждые 12 месяцев).
Выраженный эффект в отношении приливов жара и других вегетативных проявлений КС конъюгированные эстрогены, например эстрадиола валерат, оказывают обычно в дозах, не приводящих к возникновению маточных кровотечений. Наименее выраженное влияние на эндометрий оказывают препараты Э3, которому свойствен специфический кольпотропный эффект. Вместе с тем дей-
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
ствие на вегетативные реакции проявляется лишь при назначении относительно высоких доз Э3. Рекомендуемые суточные дозы эстро-генных препаратов составляют для конъюгированных эстрогенов 0,625-1,25 мг, эстрадиола валерата— 1,0-2,0 мг, Э3— 0,4-2,0 мг, эстриола сукцината — 2,0—6,0 мг, этинилэстрадиола — 0,02—0,01 мг, этинилэстрадиола сульфоната — 0,25 мг, динэстрола — 0,5—2,0 мг, эквилина сульфата — 0,25 мг. И хотя, судя по данным литературы, многие исследователи склоняются к выбору стандартной суточной дозы в размере 0,625 мг, непременным условием рациональной тактики является индивидуально дифференцированный подбор препаратов соответственно особенностям и степени гормонального дефицита пациентки. Это условие приобретает тем более важное значение, что профилактическое применение различных гормональных препаратов (как в виде монотерапии, так и в виде двух- и трехфазных схем приема комбинированных препаратов) некоторые авторы рекомендуют начинать с 50-летнего возраста или с периода, непосредственно предшествующего наступлению менопаузы, т.е. еще более молодым женщинам. Знакомство с обширными материалами литературы и личный опыт дают основание заключить, что применение препаратов эстрогенов в климактерическом периоде должно производиться по показаниям и при систематическом врачебном контроле. Назначение эстрогенов следует ограничивать случаями патологических проявлений переходного периода, обусловленных в той или иной степени дефицитом эстрогенов.
Лечению препаратами эстрогенов, особенно длительному, всегда должна сопутствовать необходимая онкологическая настороженность и учет факторов риска возможных системных нарушений. Поэтому после установления диагноза КС рекомендуется осуществление ряда рутинных мероприятий: измерение АД и определение массы тела, анализ мочи, ультразвуковое и клиническое исследование органов малого таза, цитологическое исследование влагалищного мазка и поверхностного соскоба с влагалищной части шейки матки, пальпация молочных желез. При выборе вида препарата следует принимать во внимание различия в оказываемом ими эффекте. Накопленный к настоящему времени опыт применения эстрогенов у больных с КС дает основание рекомендовать проведение прерывистых курсов лечения, начиная с 1-го года постменопаузы.
Мы с успехом применяем 4-дневный режим назначения препарата в неделю (с понедельника по четверг) с 3-дневным перерывом.
5.3. Стратегия современной постменопаузальной терапии
Реже рекомендуется прием препарата в циклическом режиме, в течение 21 дня, с недельным перерывом в каждом календарном месяце. По данным статистики, в 3/4 наблюдений лечение гормональными препаратами способствует исчезновению основных симптомов КС в течение 2,5—4 лет. У каждой 4-й больной сохраняется потребность в более длительном лечении — > 5 лет.
Необходимость длительного применения препаратов эстрогенов способствовала совершенствованию их форм и способов введения. Были созданы специальные трансдермальные системы для введения Э2, новые лекарственные формы в виде влагалищных кремов, ампул с гормонами для имплантации в подкожную клетчатку.
Трансдермальная система (например, эстрадерм TTS-50, фирма Ciba Geigi) состоит из резервуара около 3 см в диаметре с раствором Э2, ограниченного двумя мембранами. Система предназначена для заместительного и контролируемого вводимой дозой гормона лечебного воздействия. Нижняя мембрана покрыта липкой пленкой, проницаемой для Э2. Пластырь наносится на нижние отделы передней брюшной стенки. Содержащийся в синтетическом резервуаре с полунепроницаемой мембраной Э2 проникает в кожу, откуда он, медленно всасываясь, поступает в циркулирующую в подкожных капиллярах кровь. Для достижения необходимого уровня эстрогенов используются различные модификации указанной системы и режимы введения препарата. Пластырь накладывается ежедневно или 2 раза в неделю. Чрескожный способ введения препарата обладает определенными преимуществами в сравнении с другими парентеральными методами, в том числе и с влагалищным. Длительное влагалищное применение крема с Э3 не лишено определенной степени риска патологической пролиферации гормонозависимых слизистых оболочек влагалища, шейки и тела матки. При чрескожном же введении действующее начало препарата минует печеночный кровоток, что существенно снижает превращение Э2 в Э1. Одним из вариантов чрескожного способа введения является применение геля, например эстрожеля. Одна доза геля (1,50 мг 17в-эстрадиола) наносится самой женщиной, регулярно утром или вечером в виде тонкого слоя на чистую кожу предпочтительно в области живота, поясницы, предплечья или плеча. При этом следует избегать попадания препарата на кожу в области молочных желез. В клинической практике чаще используют пластырь, смена которого требуется через каждые 84 ч. У пациенток с клиническими проявлениями
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
мастопатии и/или мастодинии трансдермальные препараты в виде геля с гестагенами могут применяться непосредственно на область молочных желез. У данного контингента больных одна доза 1% про-жестожеля (25 мг натурального прогестерона) наносится на поверхность каждой молочной железы до полного впитывания 1-2 раза в сутки ежедневно.
Исследования многих центров США и Европы свидетельствуют о высокой эффективности чрескожного введения Э2 при лечении климактерических расстройств и остеопороза в период постменопаузы [31]. В целом все без исключения исследователи отмечают хорошую переносимость чрескожной терапевтической системы; некоторые кожные проблемы имели место не более чем у 1/3 наблюдавшихся женщин. Различий в эффекте при наложении пластыря на кожу передней брюшной стенки или кожу бедра не выявлено.
Любопытно сопоставить терапевтический эффект, достигаемый по основным клиническим параметрам климактерического симпто-мокомплекса, при чрескожном введении Э2 и приеме внутрь различных доз эквилиновых производных конъюгированных эстрогенов. По всем изученным параметрам благоприятные результаты достигнуты в 96 % наблюдений. По лечебному эффекту суточная доза Э2 при чрескожном введении эквивалентна 1,25 мг конъюгированных эстрогенов при пероральном применении. Чрескожная система введения Э2 в связи с достижением при ее применении высокого лечебного эффекта и хорошей переносимостью служит терапевтической альтернативной пероральному назначению препаратов конъюгированных эстрогенов.
Серьезным аргументом в пользу более широкого назначения гестагенов женщинам переходного возраста является возрастное повышение уровня секреции Э, независимо от вида принимаемых эстрогенных препаратов. Применение гестагенов способно уменьшать гиперпластические изменения эндометрия. Кроме того, одним из механизмов лечебного эффекта гормональных препаратов, обладающих гестагенными свойствами, является способность вызывать снижение содержания ЭР в гормонозависимых структурах, в результате чего последние становятся менее чувствительными к действию эстрогенов.
Для лечебных целей назначают препараты прогестеронового ряда или производные норстероидов. Выбор препарата и схему его применения определяют в соответствии со специфическими си-
5.3. Стратегия современной постменопаузальной терапии
стемными эффектами, состоянием репродуктивных органов и продолжительностью постменопаузы или особенностями перименопау-зального периода. Гестагенные препараты назначают на фоне введения эстрогенов или в каждом месячном цикле в течение 7—13 дней или (для более пожилого возраста) периодически в течение такого же отрезка времени 1 раз в 2—3 мес. Для оценки защитного эффекта циклического назначения гестагенов была изучена динамика изменений под их влиянием состояния внутриклеточных рецепторов Э2 и прогестерона эндометрия. Оптимальная продолжительность приема гестагенных препаратов до 10 дней. Снижение содержания ЭР и ПР в эндометрии наблюдалось после применения гестагенов от 6 до 10 дней и не отмечалось при более кратковременном или, напротив, более длительном их назначении.
Наиболее распространенной схемой лечения больных с приливами жара в пери- и постменопаузе при отсутствии патологии матки является циклический прием конъюгированных эстрогенов в дозе 0,625 мг с 1-го по 25-й день каждого месяца (условного лечебного цикла) с приемом гестагенов (чаще — норстероидных производных) в дозе 5 мг с 16-го по 25-й день с последующим перерывом на 5—6 дней.
При чрескожном введении Э2 рекомендуемые различными исследователями схемы назначения гестагенов отличаются определенным многообразием. В этих условиях применяют МПА внутрь в дозе 5—10 мг в течение 7—12 последних дней каждого условного лечебного цикла или препараты норэтистерона ацетата по 5 мг/сут с 22-го по 28-й день. Попытки снизить дозы препаратов норсте-роидного ряда ниже 250 мкг/сут сопровождались возникновением кровотечений прорыва. При назначении эстрогенных и гестагенных препаратов в указанных выше режимах кровотечения отмены возникают, как правило, через 3—4 дня после прекращения приема препаратов; продолжительность кровотечения — 3—4 дня. Кровотечения прорыва появляются преимущественно в виде скудных мажущих выделений; их отмечали в 2,7—6,3 % наблюдений.
При длительном назначении эстрогенов с успехом используется защитный эффект гестагенов прогестеронового ряда, назначаемых в циклическом режиме в течение 10—12 дней каждого лечебного цикла: дюфастон (дидрогестерон) в дозе 10—20 мг/сут перорально или в виде капсул с микронизированным прогестероном (утрожестан) по 2 капсулы в день (200 мг).
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
В свете рассматриваемых вопросов особого внимания заслуживают перспективы назначения больным с КС комбинированных эстроген-гестагенных препаратов.
Использование двух- и трехфазных схем при индивидуальном подборе комбинированных препаратов современных поколений значительно расширило терапевтические возможности лечения больных с теми или иными клинико-патогенетическими формами КС. Одновременно обеспечивается возможность использования при пе-роральном применении гестагенов с различными биологическими свойствами. Так, препарат трисеквенс (фирма Novo), назначаемый в непрерывном режиме, содержит в одной конволюте 12 таблеток по 2 мг эстрадиола + 1 мг эстриола в каждой; 10 таблеток по 2 мг эстрадиола + 1 мг эстриола и 1 мг норэтистерона ацетата и 6 таблеток по 1 мг эстрадиола + 0,5 мг эстриола. Двухфазный препарат дивина (фирма Orion) создан на основе иных компонентов. В конволюте содержится 11 таблеток по 2 мг эстрадиола валерата и 10 таблеток по 2 мг эстрадиола валерата и по 10 мг МПА для 21-дневного приема с 7-дневным перерывом. Величина кровопотери при кровотечениях отмены, возникающих в процессе ЗГТ в климактерическом периоде, сугубо индивидуальна и не зависит от вида гестагена, входящего в ту или иную комбинацию. У большинства пациенток кровопотеря не превышает 30 мл, что ниже обычной менструальной кровопотери.
Препарат трисеквенс у больных 45—54 лет с КС в постменопаузе продолжительностью от 0,5 до 3 лет оказывал наилучший эффект (после 2 лет заместительного лечения) на такие симптомы, как приливы жара и инсомния. У большинства женщин кровянистые выделения в ответ на отмену препарата были регулярными. Положительный эффект наступал при снижении уровня ФСГ и ЛГ до пременопаузального [4]. Признаков гиперпластических изменений или внутриэпителиального рака в эндометрии женщин после длительного применения двух- и трехфазных препаратов (от 3 до 8 лет) выявлено не было, что служит веским подтверждением защитного эффекта гестагенов. У большинства женщин, получавших трехфазный препарат в течение 12 мес, наблюдалась секреторная трансформация эндометрия.
Препарат Фемостон (Solvay Pharma) содержит в своем составе аналоги натуральных женских половых гормонов - микронизированный 17(3-эстрадиол и Дидрогестерон. Наличие разных форм предоставляет возможность выбора режима приема и дозы гормонов, индивидуально подходящих для каждой пациентки в различных возрастных группах:
• В перименопаузе — низкодозированный и классический циклический режим (Фемостон 1/10, Фемостон 2/10)
5.3. Стратегия современной постменопаузальной терапии
• В постменопаузе — низкодозированный монофазный режим (Фемостон 1/5)
После прекращения менструальной функции предпочтение отдается комбинированным эстроген-гестагенным монофазным препаратам, назначаемым в непрерывном режиме: клиогест, содержащий 2 мг 17в-эстрадиола и 1 мг ноэтистерона ацетата, или фемостон 1/5, содержащий аналогичную дозу 17(3 - эстрадиола и 5 мг. дидро-гестерона. В связи с различием в гестагенном компоненте выбор препарата основывается на степени выраженности метаболических и сердечно-сосудистых нарушений.
В клинической оценке эффективности лечебного воздействия гормональных препаратов при КС важную роль играет адекватный выбор времени контроля за действием препарата. Помимо первоначальной оценки приемлемости того или иного препарата в течение первых дней его приема, рекомендуется проводить следующее обследование спустя 4-6 мес. от начала лечения. Индивидуализация лечения должна быть особенно строгой при тяжелых формах заболевания.
При длительной ЗГТ препаратами половых гормонов в пери- и постменопаузальном периодах возникает необходимость контроля за состоянием эндометрия. В современных условиях эта задача несколько облегчается с применением УЗИ срединной маточной эхо-структуры и наличием возможности динамического исследования аспирата из полости матки. Вместе с тем появление кровянистых выделений служит абсолютным показанием для диагностического выскабливания эндометрия и гистероскопии. Диагностическое выскабливание эндометрия при приеме одних только эстрогенных препаратов без гестагенов должно производиться каждые 12 месяцев.
В лечении больных с тяжелым течением КС, в том числе развившегося на фоне сердечно-сосудистых заболеваний, давно уже с успехом используется комбинация эстрогенных и андрогенных соединений. Кроме того, показаниями для комбинированного их назначения служат тяжелые и сочетанные формы КС у больных, имеющих противопоказания для лечения эстрогенами (отягощенный семейный анамнез, экстрагенитальные опухолевые заболевания, гиперпластические процессы в матке и молочных железах, отсутствие эффекта от эстрогенных препаратов, астенодепрессивные состояния, потеря либидо, аноргазмия, остеопороз). Различные стороны подобного лечебного воздействия изложены достаточно полно в наших работах [ 1, 3]. Новым этапом развития данного направления в лечении больных КС явилось создание комбинированных инъекционных препаратов.
Глава 5. Патология репродуктивной системы в переходном и старческом возрасте
Мы располагаем опытом применения одного из подобных препаратов гинодиана-депо, в одной ампуле которого (месячная доза) эстрогены (эстрадиола валерат) и андрогены (ДЭА энантат) представлены в соотношении 1:50 [3]. Был изучен клинический и метаболический эффект препарата при лечении тяжелых клинических проявлений вегетоневротического синдрома у женщин переходного возраста, перенесших ранее гистерэктомию по поводу миомы матки. Средний возраст больных к началу лечения 49,8 ± 0,7 лет.
У всех больных проводившееся в течение первых 12—18 месяцев после операции лечение гинодианом-депо оказалось эффективным. Продолжительность курса лечения составила в среднем 6 мес. Препарат, в 1 мл масляного раствора которого содержится 4 мг эстрадиола валерата и 200 мг ДЭА энантата, вводили внутримышечно 1 раз в 30 дней. В процессе лечения отмечен положительный эффект, сопровождавшийся у большинства пациенток ликвидацией или существенным ослаблением основных вегетоневротических, психо-
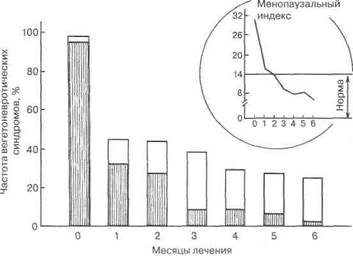
Рис. 5.8. Влияние депо-инъекций эстрадиола валерата с ДЭА энан-татом (гинодиан-депо) на течение вегетоневротических нарушений у женщин переходного возраста после удаления миомы матки. Заштрихованная часть столбцов — частота выявления средней тяжести и тяжелых форм заболевания; кривая — динамика среднего менопау-зального индекса в процессе лечения
| 5.3. Стратегия современной постменопаузальной терапии |
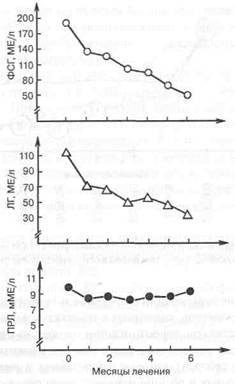
Рис. 5.9. Изменение содержания сывороточных гонадотропинов в процессе лечения гинодианом-депо
эмоциональных и обменно-эндокринных нарушений (рис. 5.8). Кроме того, общий клинический эффект проявился в положительной динамике течения сопутствующих заболеваний. Существенно уменьшилось количество больных, страдавших выраженными проявлениями ИБС, в половине наблюдений была констатирована нормализация или стабилизация уровня АД, в 3 раза уменьшилось количество больных с дисгормональными заболеваниями молочных желез, в 2,5 раза — с жалобами со стороны опорно-двигательного аппарата. Под влиянием депо-инъекций произошло отчетливое снижение уровня гонадотропинов в плазме периферической крови (рис. 5.9). Наглядная иллюстрация эффекта препарата представлена на рис. 5.10.
| Глава 5. Патология репродуктивной системы в переходном и старческом возрасте |

Рис. 5,10. Клинический метаболический эффект при лечении гиноди-аном-депо больной 52 лет с тяжелым вегетоневротическим синдромом
Применение комбинации эстрогенов и андрогенов у больных с КС имеет ряд аспектов, связанных с возможностью возникновения некоторых признаков дефеминизации, особенно при длительном лечении. К числу последних следует отнести изменения кожи (появление акне и себореи), которые наблюдаются у очень небольшого количества больных и обычно исчезают сразу после отмены препаратов. Более сложен вопрос об изменении тембра голоса у женщин, имеющих определенную профессию, — актрисы, телефонистки, дикторы. Решение этой проблемы требует тщательного индивидуального подбора оптимальных доз и схем приема гормональных препаратов.
У части женщин с противопоказаниями к применению эстрогенов положительный эффект в отношении основных проявлений климактерического симптомокомплекса может быть достигнут назначением гестагенных препаратов — производных норстероидного ряда. Имеются данные, которые позволяют рассматривать лечение гестагенами в качестве самостоятельного метода лечебного воздействия при патологии периода постменопаузы, сопровождающейся вегетоневротическими проявлениями. Такой метод лечения можно использовать у больных, подвергшихся операции по поводу доброкачественных новообразований матки и придатков. Рекомендуемые суточные дозы при проведении курса лечения норколутом — 2,5-
Дата добавления: 2016-07-09; просмотров: 716;
