Уравнение изотермы Вант Гоффа
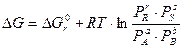 уравнение изотермы В-Г
уравнение изотермы В-Г
в состоянии химического равновесия 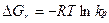 отсюда
отсюда 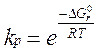 . Переходя к десятичному логорифму:
. Переходя к десятичному логорифму: 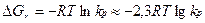
R – Универсальная газовая постоянная 8,314 Дж/моль·К.
Величина kp – ТД константа равновесия, безразмерная. Порядок и знак величины 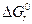 позволяет качественно предвидеть положение равновесия реакции:
позволяет качественно предвидеть положение равновесия реакции:
- если 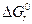 << 0, равновесие сдвинуто вправо, выход продукта велик, а const равновесия имеет большое числовое значение kp>>1.
<< 0, равновесие сдвинуто вправо, выход продукта велик, а const равновесия имеет большое числовое значение kp>>1.
- если 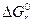 >> 0, равновесие сдвинуто влево, выход продукта мал, kp<<1 (преобладают исходные вещества)
>> 0, равновесие сдвинуто влево, выход продукта мал, kp<<1 (преобладают исходные вещества)
Значение стандартных энергий Гиббса образования многих тысяч химических соединений сведены в таблицы ТД-х свойств и приведены в справочной литературе. Можно рассчитать:
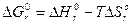 , где
, где
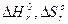 - стандартные изменения энтальпии и энтропии
- стандартные изменения энтальпии и энтропии
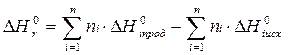 (энтальпия системы)
(энтальпия системы)
 ∆H<0 реакция экзотермическая (с выделением тепла)
∆H<0 реакция экзотермическая (с выделением тепла)
 ∆H>0 реакция эндотермическая (с поглощением тепла)
∆H>0 реакция эндотермическая (с поглощением тепла)
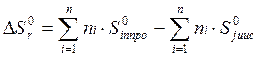 (энтропия системы)
(энтропия системы)
Стандартная энергия Гиббса:
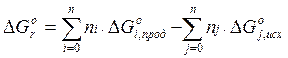
 Для протекания реакции слева на право, благоприятны большие отрицательные значения
Для протекания реакции слева на право, благоприятны большие отрицательные значения 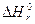 (значимый тепловой эффект) и большие положительные значения
(значимый тепловой эффект) и большие положительные значения 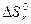 (возрастание энтропии). Повышение температуры усиливает влияние энтропийного члена
(возрастание энтропии). Повышение температуры усиливает влияние энтропийного члена 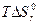 оказываемое изменением энтропии. В условиях равновесия
оказываемое изменением энтропии. В условиях равновесия 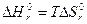 т.е. влияния энергетического и энтропийного факторов одинаково.
т.е. влияния энергетического и энтропийного факторов одинаково.
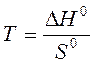 равновесная температура
равновесная температура
Решая совместно два уравнения:
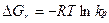
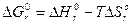
относительно  kp получим
kp получим
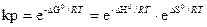
Анализ:
1. для экзотермических реакций (∆H0<0), протекающих с возрастанием энтропии (∆S0>0), kp > 1, ∆G0<0
2. для эндотермической реакции (∆Н0>0 )при убыли энтропии (∆S0<0) самопроизвольное протекание процесса невозможно.
3. если ∆H0 , ∆S0 , имеет одинаковый тот же знак, ТД вероятность протекания процесса определяется конкретными значениями ∆H0 , ∆S0 , и Т
Дата добавления: 2016-06-02; просмотров: 1048;
