Влияние температуры
Важное значение имеет тепловой эффект реакции
· повышение температуры процесса всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т.е. усиливает эндотермическое направление процесса (∆Н > 0)
· понижение температуры усиливает экзотермическое направление (∆Н < 0). При изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры ∆Т.
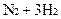 =2NH3 ∆Н<0
=2NH3 ∆Н<0
В промышленных условиях необходимо, чтобы вначале процесса, когда присутствует реагенты и практически отсутствуют продукты была высокая температура. Затем температуру понижают по линии оптимальных температур (ЛОТ) для сдвига равновесия в сторону продукта. Это достигается при помощи химических реакторов. При образовании новых связей выделяется тепло (экзотермич.) При разрушении связи тепло расходуется (эндотермическая).
Обычно устанавливают функциональную зависимость X* от константы равновесия [X* = F (KР)]. Вид этой зависимости определяется типом химической реакции. Например, для простой обратимой реакции A ↔ R зависимость X* = F (KР) может быть получена следующим путем. Константа равновесия этой реакции выражается уравнением
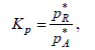 (1)
(1)
где *pA , *pR – парциальное давление соответственно реагентов A и R в состоянии равновесия.
Определим значения *pA и *pR и подставим их в уравнение (1). Для рассматриваемой реакции по уравнению имеем
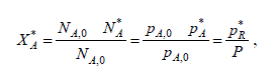
откуда
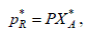 (2)
(2)
где Р – общее давление.
но
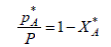
или
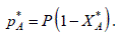 (3)
(3)
подставив 3 (1) полученные значения для *pA и *pR находим
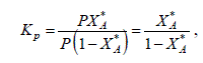
откуда
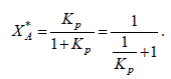 (4)
(4)
Для реакции А ↔ 2R аналогично получаем
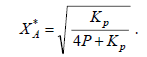 (5)
(5)
Влияние температуры на равновесие, т.е. функциональная зависимость K p = f (T ), отражается уравнением изобары Вант-Гоффа, которое имеет вид
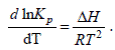 (6)
(6)
После интегрирования этого уравнения в пределах изменения температуры от T1 до T2 и при условии, что ΔH не зависит от величины Т, получаем
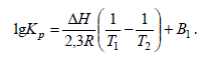 (7)
(7)
Условия применения этого уравнения ограничены небольшим интервалом температур, поскольку в действительности ΔH зависит от Т.
Для определения константы равновесия при значительном изменении температуры применяют эмпирическое уравнение типа
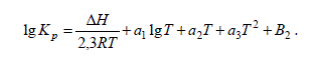 (8)
(8)
В практических расчетах часто пользуются приближенным уравнением
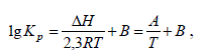 (9)
(9)
где
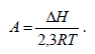 (10)
(10)
В справочной литературе имеются значения константы равновесия или коэффициенты в приведенных уравнениях для многих реакций. Если же эти сведения отсутствуют, значения констант равновесия находят экспериментально. Для этого опытным путем для каждой рассматриваемой реакции в состоянии равновесия определяют концентрации исходных реагентов и полученных продуктов при нескольких температурах. Подставив эти данные в уравнение 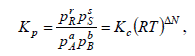 , находят константу K p . Зная константу равновесия, определяют коэффициенты в уравнениях (8) и (9). Зная зависимости
, находят константу K p . Зная константу равновесия, определяют коэффициенты в уравнениях (8) и (9). Зная зависимости
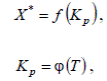 (а,б)
(а,б)
нетрудно установить зависимость X * =Ф(T). Для этого необходимо в уравнение (а) подставить значение Kp из уравнения (б)
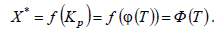
Эта зависимость является одной из самых главных в химической технологии, поскольку величина X* характеризует максимально возможное извлечение целевых продуктов из перерабатываемого сырья, а температура оказывает сильное влияние на скорость химических реакций.
Вид функциональной зависимости X * =Ф(Т ) для экзотермических и эндотермических реакций неодинаков: для экзотермических реакций X* уменьшается при повышении температуры, а для эндотермических реакций – возрастает (рис.1). Такой характер зависимости вытекает из уравнений (1) и (4).
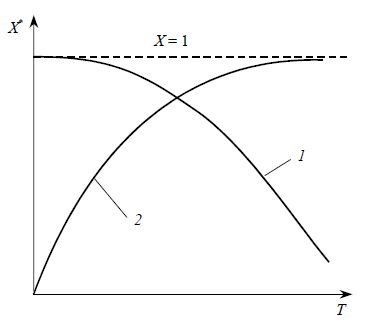
Рис. 1 – Зависимость равновесной степени превращения Х* от температуры Т: 1 – для экзотермической реакции; 2 – для эндотермической реакции
Действительно, из уравнения (9) следует, что для экзотермической реакции значение Kp уменьшается при повышении температуры, следовательно, член 1 / Kp увеличивается, а X* – уменьшается. Для эндотермической реакции, наоборот, при повышении температуры значение Kp возрастает, поэтому член 1 / Kp в уравнении (1) уменьшается, а X* увеличивается.
Выбор условий проведения процесса в промышленности можно продемонстрировать на примерах 2-х обратимых процессов, протекающих с использованием катализаторов.
Синтез аммиака N2 + 3H2 « 2NH3 представляет собой экзотермическую реакцию, в течение которой объем смеси уменьшается. В соответствии с принципом Ле-Шателье, процесс целесообразно проводить при повышенном давлении. Температура синтеза с одной стороны ограничена активностью катализатора, с другой – его термостойкостью. По этой причине режим процесса не должен выходить за рамки температурного интервала 700 – 830 К. Промышленный интерес представляет процесс с выходом продукта более 20 %. На рисунке представлены зависимости равновесной концентрации аммиака от температуры при разных значениях давления. Выполнение требуемых условий достигается на затемненном участке графика. Из проведенного ТД анализа можно сделать вывод, что для данной реакции целесообразно создание давления, превышающего значение 20 МПа. В промышленности процесс ведут при 30 МПа.
Дегидрирование бутана C4Н10 = C4Н8 + Н2 – реакция эндотермическая, протекает с увеличением объема. В отличие от рассмотренного выше примера, этот процесс целесообразно проводить при пониженном давлении или разбавлении исходной смеси инертным веществом. Понижение давления до уровня ниже атмосферного создает риск аварийной ситуации: при нарушении уплотнений в оборудовании проникший внутрь воздух создает взрывоопасную смесь с углеводородами, поэтому во избежание этой возможности используют другой вариант смещения равновесия вправо – бутан разбавляют водяным паром. Эндотермическую реакцию следует проводить при максимально возможной температуре. В данном процессе превышение температуры значения 873 К приводит к термической деструкции углеводородов. Остается отметить, что превращение бутана в промышленном процессе должно достигать не менее 50 %. На рисунке представлены зависимости равновесной степени превращения бутана от температуры при различных степенях его разбавления и выделена область необходимых температур и степеней превращения. Из проведенного анализа следует, что процесс целесообразно проводить при разбавлении бутана водяным паром в соотношении не менее, чем 8:1.
Дата добавления: 2016-06-02; просмотров: 2824;
