Способы смещения равновесия
С целью наиболее полного использования сырья желательно вести технологический процесс в условиях получения наиболее высокой степени превращения исходного вещества. Поэтому большой практический интерес представляет установление влияния различных факторов на равновесие системы (т.е. равновесную степень превращения), а также разработка приемов, позволяющих сдвинуть равновесие в сторону образования целевых продуктов.
Основными параметрами, влияющими на равновесие химических реакций, являются температура, давление и концентрация реагирующих веществ. Эти параметры обычно используются на практике для сдвига равновесия в желаемую сторону, т.е. для регулирования равновесной степени превращения.
Влияние изменения внешних условий на положение равновесия – принцип Ле-Шателье: если на систему, находящуюся в устойчивом равновесии воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесие, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия и положения равновесия сместится в том же направлении.
Рассмотрим обратимую реакцию:
aA+bB = rR+sS
реагенты продукты
Так как равновесие характеризуется равенством скоростей прямой и обратной реакции ( 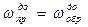 ), можно сказать, что смещение равновесия происходит тогда, когда произведенное воздействие неодинаково влияет на скорость прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при которой
), можно сказать, что смещение равновесия происходит тогда, когда произведенное воздействие неодинаково влияет на скорость прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при которой 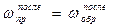 снова, но будут отличаться от первоначальных значений.
снова, но будут отличаться от первоначальных значений.
Влияние давления
 Влияние давления определяется знаком изменения объема ∆V (или знаком разности числа молей газообразных веществ): для реакций, протекающих с увеличением числа молей(∆n>0) увеличение давления не благоприятно. Смещению равновесия реакции вправо способствует снижение давления. Для реакций с уменьшением числа молей (∆n<0) , целесообразно повышению давления (p ).
Влияние давления определяется знаком изменения объема ∆V (или знаком разности числа молей газообразных веществ): для реакций, протекающих с увеличением числа молей(∆n>0) увеличение давления не благоприятно. Смещению равновесия реакции вправо способствует снижение давления. Для реакций с уменьшением числа молей (∆n<0) , целесообразно повышению давления (p ).
Чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объема сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии.
Например: N2 + 3H2 ↔ 2NH3 (a)
СН4 ↔ С + 2Н2 (б)
СО + Н2О ↔ H2 + СО2. (в)
Поскольку реакция (а) протекает с уменьшением объема, то, исходя из принципа Ле-Шателье, для смещения равновесия слева направо необходимо повышать давление.
На практике так и поступают – процесс ведут под давлением 32,0 МПа (320 кгс/см2).
Для реакции (б), протекающей с увеличением объема, для смещения равновесия слева направо необходимо, наоборот, понижать давление. На равновесие реакции (в) изменение давления не влияет, т.к. объем системы в процессе реакции не изменяется.
Дата добавления: 2016-06-02; просмотров: 821;
