Равновесие химических реакций
Термодинамические расчеты ХТП
Физико-химические закономерности ХТП
При проектировании технологических процессов очень важны ТД расчеты химических реакций. Они позволяют сделать вывод:
1. о принципиальной возможности данного хим. превращения;
2. предварительно выбрать условия проведения процесса;
3. определить равновесный состав продуктов;
4. рассчитать теоретически достижимые степени превращения исходных веществ и выходы продуктов;
5. энергетические эффекты: теплота реакции, теплота изменения агрегатного состояния, что необходимо для составления энергетических балансов и определить энергетических затрат.
ТД система называется однородной, если во всех частях системы свойства одинаковы. Совокупность физических свойств рабочего тела (или ТД система) в рассмотренных условиях называется состоянием тела (или системы). Величины, характеризующие состояние ТД системы называют ТД параметрами (давление, температура, удельный объем, плотность, молярный объем, удельная внутренняя энергия и т.д.)
ТД параметры делят на экстенсивные и интенсивные.
Экстенсивные – величины, пропорциональные массе (количеству вещества) рассматриваемого рабочего тела или ТД системы (объем внутренняя энергия энтальпия, энтропия и т.п.), обладающие свойством аддитивности – способность суммирования.
Интенсивные – не зависят от массы ТД системы, они служат ТД параметрами состояния (температура, давление, а так же экстенсивные величины, отнесенные к единице массы, объема, количества вещества.)
Истинные параметры состояния – только интенсивные.
Изменение интенсивных параметров для ускорения ХТП называется интенсификацией.
Равновесие химических реакций
Представление о том, насколько глубоко может протекать химическая реакция, можно получить на основании данных о равновесии этой реакции. Условия достижения равновесия имеют большое практическое значение, поскольку ими определяется полнота использования сырья. Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния ТД системы (значений ТД параметров) называемое ТД процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний называют равновесными. При этом равновесным считают состояния, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени ТД параметров и отсутствием в системе потоков вещества и теплоты.
Устойчивое равновесие характеризуется следующими общими условиями:
1. неизменностью равновесного состояния системы во времени при постоянных внешних условиях;
2. подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызванного отклонения системы от положения равновесия ) (принцип Ле-Шателье)
3. динамическим характером равновесия, т.е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов;
4. возможность подхода к состоянию равновесия с 2-х противоположных сторон;
5. минимальным значением энергии Гиббса G в изобарно-изотермических и энергии Гельмгольца F в изохорно-изотермических процессах (dG=0, d2G>0, dF=0, d2f>0)
Химические реакции, как правило, обратимы: наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает взаимодействие и между продуктами (обратная реакция). По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакций становятся равными – наступает состояние химического равновесия. Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях. Так как условием равновесия при постоянных Т и р служит минимум энергии Гиббса (dG=0), то в условиях химического равновесия должно также соблюдаться равенство
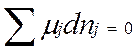
где μj- химический потенциал компонента J; nj- количество компонента J (моль).
Известно, что химическим потенциалом называется величина
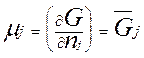
Большая положительная величина μ указывает на высокую реакционную способность частиц.
Закон действующих масс (закон равновесных концентраций)
Кинетический вывод ЗДМ на примере гомогенной реакции
аА+вВ=rR+sS
Скорость прямой реакции пропорциональна произведению концентраций исходных реагентов А и В:
ωпр=k1·CAa ·CBb,
а скорость обратной реакции – произведение концентраций продуктов R и S:
ωобр=k2·CRr·CSs.
Степени – стехиометрические коэффициенты компонентов в химическом уравнении. В момент хим. равновесия:
k1·CAa ·CBb = k2·CRr·CSs
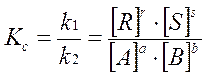 выражение ЗДМ (отношение констант скоростей, называемое константой равновесия)
выражение ЗДМ (отношение констант скоростей, называемое константой равновесия)
где 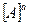 ,
, 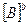 …– равновесные концентрации
…– равновесные концентрации
Как следует из выражения, const равновесия не зависит от концентрации, т.к. изменение концентрации одного из участников реакции вызовет такие изменения концентр всех остальных веществ, что kc сохранит свое числовое значение. Т.о. основное значение ЗДМ состоит в том, что он устанавливает связь между равновесными концентрациями всех реагирующих веществ.
Для реакций, протекших в газовой фазе, константу равновесия выражают через парциальные давления:
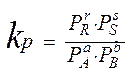
Pi=Ni·p- парциальное давление (из з-на Дальтона)
Ni- молярные доли
Т.к. в соответствии с уравнением состояния ид. газа
Ур-е Менделеева-Клайперона
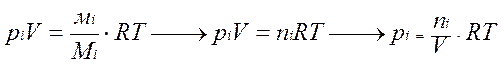

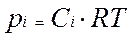 , можно выразить
, можно выразить

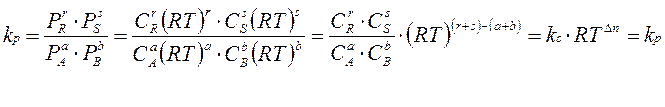 где ∆n=(r+s)-(a+b), если все участники реакции – газообразные вещества. Если ∆n=0 (a+b)=(r+s) (то есть ∆ V=0), получаем: kc=kp при ∆n=0.
где ∆n=(r+s)-(a+b), если все участники реакции – газообразные вещества. Если ∆n=0 (a+b)=(r+s) (то есть ∆ V=0), получаем: kc=kp при ∆n=0.
Константу равновесия можно выразить также через отношение молярных долей Ni, участников реакции: 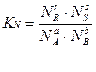 ,
,
или через их количество ni (моль): 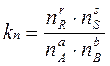
Для реальных систем константу равновесия выражают через :
летучести f 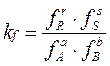
активности a 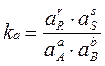 .
.
При небольших давлениях при любых температурах:
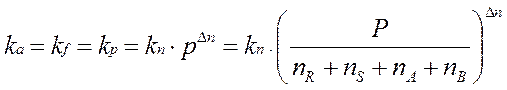
Дата добавления: 2016-06-02; просмотров: 898;
