Электролитическая диссоциация
Заряженные частицы, обеспечивающие электрический ток в этих растворах, образуются в результате электролитической диссоциации. Из-за взаимодействия с полярными молекулами воды молекулы растворяемых веществ распадаются на разноименно заряженные «осколки» – ионы. Положительно заряженными оказываются ионы металлов и водорода, а отрицательно заряженными – кислотные остатки и гидроксильная группа (ОН).
Рассмотрим этот процесс подробнее на примере бромида калия KВr.
Взаимодействие атомов брома и калия в молекуле бромида калия упрощенно можно представить как взаимодействие двух ионов: положительно заряженного иона K+ и отрицательно заряженного иона Вr– . Объясняется это тем, что единственный валентный электрон у калия слабо связан с атомом. При образовании молекулы KВr этот электрон переходит к атому брома, превращая его в отрицательный ион Вr–. В соответствии с этим молекулу KВr можно схематически изобразить в виде диполя (рис. 22.1). При растворении соли бромида калия в воде молекулы KВr попадают в окружение молекул воды, которые тоже являются диполями.
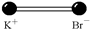 Рис. 22.1 Рис. 22.1
| 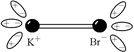 Рис. 22.2 Рис. 22.2
|
В электрическом поле, создаваемом молекулой KВr, молекулы воды ориентируются, как показано на рис. 22.2. При этом они растягивают молекулу KВr настолько, что незначительная встряска при столкновении с другими молекулами, участвующими в тепловом движении, разрушает ее. Часть молекул KВr распадается – диссоциирует на ионы K+ и Вr–.
Степень диссоциации, т. е. доля молекул растворенного вещества, которые распадаются на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости e растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Наряду с процессом диссоциации в растворах электролитов происходит и обратный процесс. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать (воссоединяться). При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь воссоединяются в нейтральные молекулы. При наступлении динамического равновесия концентрация ионов в растворе электролита сохраняется постоянной (при неизменной температуре).
Дата добавления: 2016-04-11; просмотров: 1064;
