Техническое применение электролиза
Гальваностегия– покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет (рис. 22.4). Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними.
Рис. 22.4 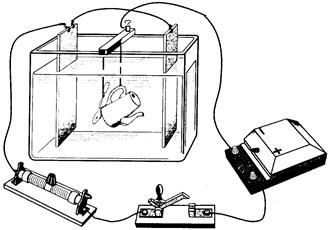
Гальванопластика– электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала
Рафинирование меди
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди – катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
СТОП! Решите самостоятельно: А1, А2, В1, В2.
Закон Фарадея
В 1836 г. английский ученый Майкл Фарадей экспериментально установил, что масса вещества, выделяющегося на каждом электроде, прямо пропорциональна силе тока и времени прохождения тока через электролит:
m = kIt, (22.1)
где k – коэффициент пропорциональности, который называют электрохимическим эквивалентом вещества.
Размерность k:
[k] = 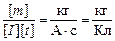 .
.
Так как It – это заряд q, проходящий через электролит в течение времени t, то формулу (22.1) можно записать в виде
m = kq. (22.2)
Физический смысл k прост: k – это масса вещества, выделившаяся на электроде при переносе заряда q = 1 Кл.
Экспериментально установлено, что величина k зависит только от молярной массы и заряда иона вещества. Почему так, мы выясним немного позже.
Таблица 22.1
Дата добавления: 2016-04-11; просмотров: 1540;
