Определение заряда электрона
Зная постоянную Авогадро NA и постоянную Фарадея F, можно найти модуль заряда одновалентного иона, т. е. заряд электрона:
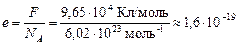 Кл.
Кл.
Любой двухвалентный ион переносит заряд в два раза больший, трехвалентный – в три раза больший и т. д. Но никогда не бывает, чтобы один ион переносил заряд, содержащий дробную часть заряда одновалентного иона.
Этот вывод, полученный из закона Фарадея, впервые в истории физики привел к мысли о том, что заряд одновалентного иона (е = = 1,6×10–19 Кл) представляет собой наименьший (элементарный) заряд, существующий в природе. Любой электрический заряд состоит из целого числа элементарных зарядов.
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в 1881 г., когда в науке еще не существовало представления об электроне. Значение элементарного заряда, вычисленное на основании закона электролиза, совпадает со значением заряда электрона, которое в дальнейшем было получено при исследовании других явлений.
Задача 22.2. Никелирование металлического изделия с поверхностью S = 120 см2 продолжалось t = 5,0 ч при силе тока I = 0,30 А. Определить толщину h слоя никеля. Атомная масса никеля А = = 58,7; валентность никеля п = 2; плотность r = 8800 кг/м3.
| S = 120 см2 = 0,0120 м2 t = 5,0 ч = 1,8×104 с I = 0,30 А А = 58,7 п = 2 r = 8800 кг/м3 | Решение. Заметим, что если А = 58,7, то молярная масса m = 0,0587 кг/моль. Согласно формуле (22.6)
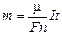 . (1)
С другой стороны, масса никеля
т = rhS. (2) . (1)
С другой стороны, масса никеля
т = rhS. (2)
|
| h = ? |
Подставляя (2) в (1), получим
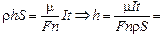
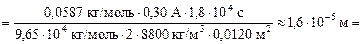 16 мкм.
16 мкм.
Ответ: 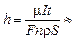 16 мкм.
16 мкм.
СТОП! Решите самостоятельно: А6–А10, В9–В11, С2, С3.
Задача 22.3.При электролизе подкисленной воды через ванну прошел заряд q = 2500 Кл. Выделившийся кислород находится в объеме V = 0,50 л под давлением р = 101 кПа. Какова его абсолютная температура Т?
| q = 2500 Кл V = 0,50 л = 5,0×10–4 м3 р = 101 кПа = 101×103 Па | Решение. Заметим, что если молярная масса иона кислорода О–2 m0, то молярная масса молекулы кислородаО2 – 2m0. Масса кислорода, выделившегося на аноде, определяется по формуле |
| Т = ? | |
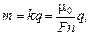 (1)
(1)
где п = 2. С другой стороны, для образовавшегося молекулярного кислорода О2 справедливо уравнение Менделеева–Клайперона:
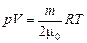 . (2)
. (2)
Подставляя (1) в (2), получим

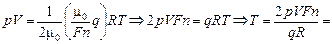
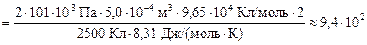 К.
К.
Ответ: 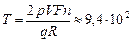 К.
К.
СТОП! Решите самостоятельно: В12, С4, С5.
Задача 22.4. Медь выделяют из раствора CuSO4 при напряжении 10 В. Найти расход электроэнергии на 1 кг меди (без учета потерь). Электрохимический эквивалент меди 3,3×10–7 кг/Кл.
| U = 10 В k = 3,3×10–7 кг/Кл | Решение. С одной стороны, согласно закону Фарадея m = kIt. (1) С другой стороны, по закону Джоуля–Ленца |
| Wm = W/m = ? | |
W = UIt. (2)
Разделив (2) на (1), получим
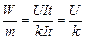 .
.
Итак,
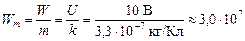 Дж/кг.
Дж/кг.
Ответ: 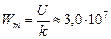 Дж/кг.
Дж/кг.
Читатель: Получается, чем меньше напряжение, тем меньше и затраты энергии на получение 1 кг меди!
Автор: Да! Но чем меньше U, тем меньше ток, а значит, тем больше времени уйдет на этот процесс. А за большее время потери энергии в различных участках цепи тоже возрастут. Поэтому доводить напряжение до нуля все-таки не стоит.
СТОП! Решите самостоятельно: А12, В13–В14, С6.
Дата добавления: 2016-04-11; просмотров: 10494;
