Как определить электрохимический эквивалент?
Читатель: По-моему, это чисто экспериментальная задача.
Автор: Да, если… нам не удастся вывести закон Фарадея чисто теоретически! Давайте попробуем.
Масса т выделившегося вещества равна произведению массы одного иона тi на число ионов Ni, осевших на электроде за время Dt:
т = miNi. (1)
Масса иона, как мы уже знаем, равна
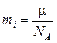 , (2)
, (2)
где m – молярная (или атомная) масса вещества, a NA – постоянная Авогадро, т. е. число ионов в одном моле. Число ионов, осевших на электроде,
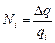 , (3)
, (3)
где Dq = IDt – заряд, протекший через раствор электролита за время Dt, qi – заряд иона, который равен произведению элементарного заряда е на валентность п атома (или группы атомов), из которого образовался ион: qi = en.
При диссоциации молекул, состоящих из одновалентных атомов (п = 1), возникают однозарядные ионы. Например, при диссоциации молекулы бромида калия KВr возникают ионы K+ и Вr–, а при диссоциации молекулы медного купороса CuSO4 получаются два двухзарядных иона Сu2+ и  , так как атом меди и кислотный остаток в данном соединении двухвалентны (п = 2). Подставляя в формулу (1) выражения (2) и (3) и учитывая, что Dq = IDt и qi = en, получим
, так как атом меди и кислотный остаток в данном соединении двухвалентны (п = 2). Подставляя в формулу (1) выражения (2) и (3) и учитывая, что Dq = IDt и qi = en, получим
 .
.
Итак,
 . (22.3)
. (22.3)
Сравнивая (22.3) с (22.1), нетрудно заметить, что
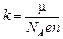 . (22.4)
. (22.4)
Поскольку 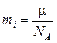 – масса иона, а еп = qi – заряд иона, то выражение для k примет вид:
– масса иона, а еп = qi – заряд иона, то выражение для k примет вид:
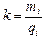 , (22.5)
, (22.5)
т.е. величина k – это отношение массы иона к его заряду.
Постоянная Фарадея
Произведение элементарного заряда (заряда электрона) е на постоянную Авогадро NА носит название постоянной Фарадея: F = eNA. Введя постоянную Фарадея в формулу (22.3), для массы вещества, выделившегося при электролизе наэлектроде, получим:
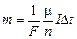 . (22.6)
. (22.6)
Согласно этой формуле постоянная Фарадея F численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде один моль одновалентного вещества. Постоянная Фарадея, найденная из опыта, равна F = 9,65×104 Кл/моль. Для выделения на электроде одного моля п-валентного вещества через раствор электролита необходимо пропустить заряд, численно равный произведению nF.
Сравнивая формулы (22.6) и (22.1), можно получить еще одну формулу для k:
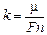 . (22.7)
. (22.7)
Дата добавления: 2016-04-11; просмотров: 2212;
