Ионное равновесие; электрохимический потенциал; профили потенциала и концентрации у границы раздела фаз; коэффициент распределения; двойной электрический слой
Транспорт ионов.
Движущая сила диффузии через мембрану в случае незаряженных частиц – разность химических потенциалов µ между областями, разделенными полупроницаемой мембраной (ПМ). Напомню, что µ=µ0+RTlnC. Если через мембрану движутся заряженные частицы – например, ионы, - то это движение зависит не только от разности химических потенциалов, но и от разности электрических потенциалов. В этом случае пользуются электрохимическим потенциалом µ с чертой, которую не знаю как пставить. µ=µ0+RTlnC+zFφ. Собственно, движущей силой для ионов является грдиент этого потенциала, который по определению является производной потенциала по напавлению dµ/dx.
Рассмотрим, что происходит, когда ион проникает в мембрану. Диэлектрическая постоянная εлипидов=2-3, а εводы=81. Следовательно, энергия иона с радиусом r - E=e2/2rε – повышается в липидном слое! Следовательно, коэффициэнт распределения иона между водой и мембраной очень мал (напомню, что коэффициэнт распределения γ=Слип/Cводы, это отношение концентраций иона ооооочень близке к границе с одной и с другой стороны). Он равен 10-20-10-30. Это значит, что в воде ооооооооооооочень много, а в мембрану проникает оооооооооочень мало.
Рассмотрим распределение электролита А+В- между липидной (2) и водной (1) фазами. Пусть липофильность В- больше, чем у А+. Поэтому вблизи границы в липидной фазе будет побольше анионов, следовательно, липидная фаза около границы будет иметь отрицательный заряд! Однако вдали от границы концентрации катионов и аноинов будут одинаковыми (потому что если ты уже в глубине липидной фазы, то в гробу все видали твою липофобность, тебе уже деваться некуда), так что соблюдается условие электронейтральности объемов(!) фаз (но не самой мембраны): CA=CB. В целом, концентрация обоих ионов ниже в липидной фазе, так как в ней у ионов горааздо выше энергия, им не выгодно (из-за разности в диэлектрических проницаемостях).
На рисунке: профили распределения потенциала и концентраций ионов А+ и В- на границе раздела фаз I и II. Фаза I – водный раствор, а – распределение φ, б – распределение С. С1 и С2 – концентрации в объемах фаз I и II
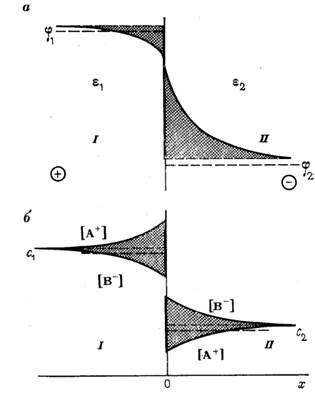
Кому не понятно, объясняю, че тут нарисовано. б – это концентрации. Мы видим, что вблизи границы А больше, чем В в водной фазе, а В больше, чем А в липидной. Но при этом и того, и другого в водной больше. По мере удаления от границы концентрации выравниваются до соблюдения электронейтральности в объемах фаз. А вблизи границ электронейтральности нет.
Пусть у нас установилось равновесие! Тогда электрохимические потенциалы фаз равны: µ0А(1)+RTlnCA(1)+Fφ(1)= µ0А(2)+RTlnCA(2)+Fφ(2). Ключевой момент в том, что СОВСЕМ вблизи границы φ(1)= φ(2) (видно из профиля, да и логично, совсем на границе потенциалы фаз равны). Следовательно, µ0А(1)+RTlnCA(1)= µ0А(2)+RTlnCA(2). Вспоминаем, что γ=Слип/Cводы, и пишем: ln γA=Δµ0A/RT,(Δµ0A= µ0А(1)- µ0А(2)), аналогично для В.
При условии электронейтральности обеих фаз: CВ(1)=С1 и CA(2)= CВ(2)=С2, так что ln(C2/C1)=1/2* (ln γA + ln γB) (я этого не смог понять!) илиC2/C1=√( ln γA * ln γB).
Отношение концентраций электролита в фазах зависит от γA и от γB. Величина разности потенциалов Δφ=φ1-φ2 между фзами зависит от разности электрохимических потенциалов обоих ионов. Опять же, не в состоянии понять, почему: Δφ=φ1-φ2=1/2F*(Δµ0B-µ0A)=2F/RT*( ln γA - ln γB). Вывод: межфазная разность потенциалов возникает, только если коэффициенты распретеделения катионов и анионов различны (то есть разная липофильность, в данном случае).
Характер падения потенциала вблизи границы зависит от распределения ионов в двойной электрическом слое (двойной слой возникает у заряженных мембран. 1 слой – на самой мембране, т.к. она заряжена, второй – от электролита). Эмперический факт: потенциал падает при отдалении от границы экспоненциально: φ(х)=φ0exp(χ|x|). χ – константа, зависящая от концентрации ионов в данной фазе и диэлектрической проницаемости. Потенциал падает в е раз на расстоянии x=1/ χ от границы. Величина λ=1/ χ – длина экранирования. Она падает при увеличении концентрации электролита в данной фазе (иными словами, при увеличении концентрации электролита в данной фазе потенциал падает быстрее при удалении от границы). Поэтому в разбавленных растворах толщина двойного диффузинного слоя – сотни ангстрем, а в концентрированных – единицы. Еще поэтому в липидном слое, где концентрация ниже, длина экранирования больше. Намного. Поэтому, если мембрана тонкая (ее толщина заметно меньше длины экранирования), то скачок потенциала внутри мембраны почти отсутсвует. Иными словами, в отсутсвии внешнего поля, потенциал тонкой мембраны постоянен по всей толщине! Поэтому значения потенциала в тонкой мембране не отличаются от уровня потенциала окружающих растворов на любом удалении от мембраны (не понял мысль...). Именно так и происходит в незаряженных бислойных липидных мембранах толщиной 70-100 ангстрем. Если приложить внешнее поле, то внутри мембраны потенциал будет меняться линейно, то есть градиент приложенного потенциала в мембране постоянен: dφ/dx=const.Однако, если поверхность мембраны заряжена, то около поверхности образуется двойной электрический слой. Противоионы электролита с одной стороны будут удерживаться мембраной электростатически, а сдругой – тепловое движение хочет их вернуть равномерно в лбъем электролита. Короче, потенциал на поверхности такой мембраны сложным образом зависит от плотности поверхностного заряда, равновесной концентрации электролита в растворе и температуры.
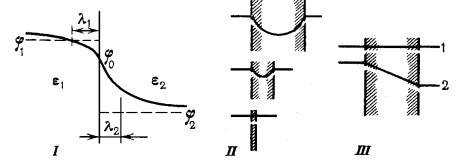
На рисунке профили распределения потенциала на границе раздела фаз – I. В мембранах разной толщины – II. В тонкой мембране в отсутсвии внешнего поля – III.1, и в присутсвии (т.е. при наложении разности электрических потенциалов) – III.2. φ1 и φ2 –электрические потенциалы в объеме фаз, φ0 – на границе раздела фаз. Остальное в тексте.
Теперь немного про Доннановское равновесие.
Представим себе корыто, разделенное на две части – 1 и 2 – полупроницаемой мембраной (ПМ), через которую проходят и катионы, и анионы нашего электролита A+B-, но не проходят фиксированные заряды Q (скажем, аминокослота какая-нить), находящиеся во второй части корыта. Направим ось x слева направо.
Напишем, чем равен электрохимический потенциал 1 и 2. µа1= µа0+RTlnCа1+zFφ1, аналогично для 2.(Еще отныне забьем на z, так как будем считать, что у нас все одновалентное). И аналогично для аниона В.
Поскольку установилось равновесие, то Δµ= µ1 - µ2=0=>RT ln(C1/C2)+F(φ1 – φ2)=0 => φ1 – φ2=RT/F* ln(Ca2/Ca1)=- RT/F* ln(Cb2/Cb1) - уравнение Нернста. Вах, равновесный потенциал определяется соотношением концентраций электролитов в обеих фазах.
Если Са1=Са2=Сb1=Cb2=С, то Δφ=0. Из уравнения Нернста следует, что Са2Сb2= Са1Сb1=C2.
Пусть во второй фазе есть фиксированные заряды – Q. Его влияение приведет к тому, что Δφ уже не равно нулю, капитан.=) Из условия электронейтральности первой фазы следует:
Са1=Сb1=С, а для второй фазы Са2+Q=Cb2. Значит, Са2< Cb2, Са2 Cb2= Са12=C2, Са2> Са1. Значит, содержание Q во второй фазе компенсируется повышенном содержанием в ней анионов В и пониженном – катионов А. В этом случае возникает доннановская разность потенциалов: ΔφD=φ1 – φ2=RTln(Са1/ Са2)= RT/F*ln(C/ Са2)>0, где Са2<C.
| <== предыдущая лекция | | | следующая лекция ==> |
| Типы объемных взаимодействий в белковых макромолекулах. | | | Производственный процесс: понятие, классификация и структура |
Дата добавления: 2016-04-11; просмотров: 1942;
